Навигация
Моль 2моль 1 моль 2 моль
2 моль 2моль 1 моль 2 моль
1) mр-раCuSO4 = Vр-ра ![]() = 400мл 1,02г/мл = 408г = mр-ра до реакции
= 400мл 1,02г/мл = 408г = mр-ра до реакции
2) ![]() (CuSO4 ) =
(CuSO4 ) = ![]()
3) По условию процесс продолжается до тех пор, пока масса не уменьшилась на 10г, значит на электродах выделилось 10г веществ – меди и газообразного кислорода.
4) По уравнению реакции: ![]()
Пусть 1 часть продуктов (Cu и О2) содержит х моль вещества,
тогда ![]() моль;
моль; ![]() моль
моль
5) m(O2) = 32x , г
m(O2) = 32x , г m(O2) + m(Cu) = 10
32(x) + 64 ![]() 2x = 10
2x = 10
160x = 10
x = 0,0625
Значит: m(O2) = 32 г/моль 0,0625 = 2г
m(Cu) = 64 г/моль 2 0,0625 моль = 8г
6) m1(H2SO4) =![]() (H2SO4) М(H2SO4)
(H2SO4) М(H2SO4)
7) ![]() (H2SO4) =
(H2SO4) = ![]() (Cu) = 2 0.0625 моль = 0,125 моль
(Cu) = 2 0.0625 моль = 0,125 моль
8) m1(H2SO4) = 0,125 моль 98 г/моль = 12,25г
9) mобщ. (CuSO4) = mр-раCuSO4 ![]() (CuSO4) = 408г 0,06 = 24,48г
(CuSO4) = 408г 0,06 = 24,48г
10) m1(CuSO4) = ![]() (CuSO4) М(CuSO4)
(CuSO4) М(CuSO4)
![]() (CuSO4)
(CuSO4) ![]() (Cu) = 2 0,0625 моль = 0,125 моль
(Cu) = 2 0,0625 моль = 0,125 моль
m1(CuSO4) = 0,125 моль 160 г/моль = 20г
11) mизбытка(CuSO4) = 24,48 – 20г = 4,48г
12) mр-ра после реакции = mр-ра до реакции - m(Cu; O2) = 408г – 10г = 398г
13) ![]() (CuSO4) =
(CuSO4) = ![]() 0,0112 (1,12% CuSO4 в оставшемся растворе)
0,0112 (1,12% CuSO4 в оставшемся растворе)
14) ![]() (Н2SO4) =
(Н2SO4) = ![]()
![]()
![]() 0,0308 (3,08% Н2SO4 в оставшемся растворе)
0,0308 (3,08% Н2SO4 в оставшемся растворе)
Ответ: ![]() На электродах выделилось: m(Cu) = 8г; m(O2) = 2г; в оставшемся растворе:
На электродах выделилось: m(Cu) = 8г; m(O2) = 2г; в оставшемся растворе: ![]() (CuSO4) =0,0112 (1,12%)
(CuSO4) =0,0112 (1,12%)
![]() (Н2SO4) = 0,0308 (3,08%)
(Н2SO4) = 0,0308 (3,08%)
Задача № 8
При электролизе раствора хлорида металла катион которого двухзаряден, на катоде выделилось 0,16г металла. При растворении этой массы металла в концентрированной азотной кислоте выделился бурый газ объемом 0,112 (н.у.) Определите состав хлорида и его массу в растворе.
Решение
II
MeCl2
m(Me) = 0,16г
m(NO2) = 0,112л
н.у.
| MeCl2 - ? m(NCl2) - ? |
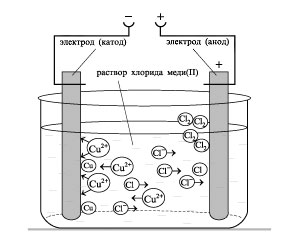
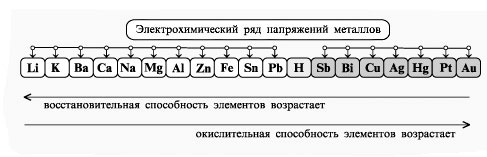
1) По условию, на катоде выделяется чистый металл, значит этот металл может находиться в ряду активности металлов «после водорода» раствор
MeCl2 = Ме2++ 2Cl–m=0,16г
![]() 1 2 2 Me2+ +2
1 2 2 Me2+ +2![]()
![]() Me 0 (по условию)
Me 0 (по условию)
![]() 1 2 2Cl— - 2
1 2 2Cl— - 2![]()
![]() Cl 0
Cl 0
![]() Me2+ + 2Cl — Me 0 +Cl 0
Me2+ + 2Cl — Me 0 +Cl 0
![]() (H2O)
(H2O)
на катоде : Me2+, H2O (H+)
![]()
на аноде : Cl –, H2O
2) По условию реакции (1) нельзя однозначно вычислить ![]() (MeCl2), так как в условии задачи нельзя не говорится о том, что процесс электролиза прошел до конца, поэтому основные расчеты проводим по уравнению реакции (2)
(MeCl2), так как в условии задачи нельзя не говорится о том, что процесс электролиза прошел до конца, поэтому основные расчеты проводим по уравнению реакции (2)
ί m = 0,16г
MeCl = Me ↑ + Cl2↓ (1)
(H2O)
m = 0,16г II V = 0,112л
Me + 4HNO3 = Me(NO3) + 2NO2↑ + 2H2O2 (2)
Похожие работы
... пособие по прикладной химии «Задачи по теоретическим основам химической технологии», составленное по материалам представленной работы. 3. Методика решения задач по теоретическим основам химической технологии Одна из главных задач химической науки и промышленности - получение необходимых человеку веществ (продуктов, материалов). Поэтому большинство учебных химических задач снизано с ...
... . - Формирование навыков техники выполнения эксперимента, умения решать расчетные и качественные задачи, составлять уравнения химических реакций, протекающих при электролизе растворов и расплавов электролитов.- Воспитание самостоятельности, организованности, формирование умения работать в группе, развитие творческих способностей, логического мышления, внимания, памяти. Оборудование: компьютер, ...
... его с кислородом или воздухом). Глава 3. Методические разработки по "Водород. Кислоты. Соли" Цели урока: Обучающие: создать условия для обобщения и систематизации знаний учащихся по теме: «Водород. Кислоты. Соли», продолжить формировать умение классифицировать неорганические вещества; закрепить основные понятия «оксиды», «кислоты», «соли», «индикатор»; уметь выделять главное. Развивающие: ...
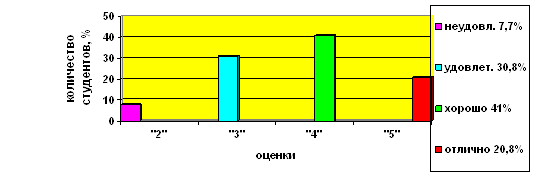
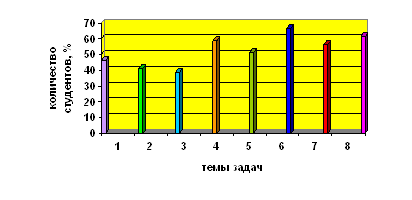
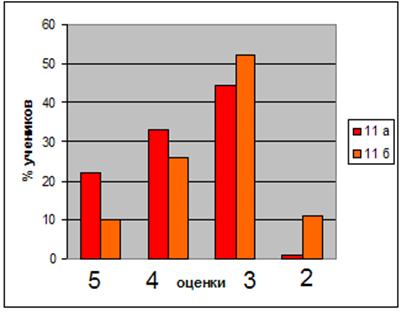
... учащихся Диаграмма 2. Динамика успеваемости и качества обучения Таким образом, можно сделать вывод, что предложенная в работе гипотеза, что разработка и реализация новых методических подходов к изучению темы «Бериллий» позволят заметно повысить уровень знаний, научной культуры, уверенности в своих способностях школьников нашла свое подтверждение в результате наших исследований. ЛИТЕРАТУРА ...




0 комментариев