Навигация
Культурально-біохімічні властивості штамів продуцентів
3.1 Культурально-біохімічні властивості штамів продуцентів
3.1.1 Штам E.coli M 17
Виробничий штам E.coli M17(О2: К1: Н6) відноситься до виду Escherichia coli, роду Escherichia, трибу Eschericiеaе, родини Enterobacteriaceae. Штам E.coli M17 являє собою рухомі грамнегативні короткі палички з закругленням на кінцях, довжиною від 1,5мкм до 4,0 мкм.
Штам E.coli M17- факультативний аероб, на МПА через (15![]() 3) год утворює круглі випуклі S-колонії 0,3-0,5 см в діаметрі з рівними краями, або сухі плоскі R-колонії з нерівними краями. На середовищі Ендо утворює червоні колонії з металевим блиском. На МПБ через (3
3) год утворює круглі випуклі S-колонії 0,3-0,5 см в діаметрі з рівними краями, або сухі плоскі R-колонії з нерівними краями. На середовищі Ендо утворює червоні колонії з металевим блиском. На МПБ через (3![]() 1) год відбувається рівномірне помутніння середовища і утворення осаду, або плівки чи пристіночного кільця. На кровяному агарі може давати повний гемоліз.
1) год відбувається рівномірне помутніння середовища і утворення осаду, або плівки чи пристіночного кільця. На кровяному агарі може давати повний гемоліз.
Штам розщеплює з утворенням кислоти і газу глюкозу, лактозу, манніт, мальтозу, сахарозу; желатин не розжирує; утворює індол.
Оптимальна температура росту штаму E.coli M 17 (37![]() 1)ºС.
1)ºС.
Штам E.coli M17 проявляв антагоністичну дію по відношеню до патогенних та УПМ, які використовуються при контролі пробіотиків.
Показник антагоністичної активності виробничого штаму E.coli M17 по відношенню до тест-штамів шигел Флекснера повинен бути не нижче 60%, а по відношенню до тест-штамів шигел Зонне – не нижче 30%
3.1.2 Штам B.cereus IP 5832
Виробничий штам B.cereus IP 5832 відноситься до виду Bacillus cereus, роду Bacillus, родини Bacillaceae. Штам являє собою рухому грампозитивну паличку із закругленими кінцями, довжиною 5-10 мкм і товщиною 1-2 мкм. Клітина- спорангій утворює одну ендоспору. Хемогетеротроф.
Штам B.cereus ІР 5832 – аероб, на МПА утворює білі, тверді, круглі або жовтуватого кольору “розплющені” колонії з нерівними краями; на кровяному агарі колонії зернисті, із широкою зоною гемоліза; на яєчному агарі утворює широку зону преципітації білого кольору (ефект бактеріальної лецитінази), зона швидко росте і через декілька діб інкубації охоплює всю поверхню чашки. Колонії, які виросли на агарі, мають характерний восковидний вид. В рідкому поживному середовищі бацила утворює білий хлоп`євидний осад, ніжну плівку на поверхні і визиває помутніння бульйона.
Штам володіє високою протеолітичною активністю – розріджує желатин протягом 1-4 діб; утворює лецитиназу і ацетилметилкарбінол, розщеплює до кислоти глюкозу і мальтозу, гліцерин, лактозу, галактозу інсулін, дільцит і декстрин.
Температурний оптимум росту 30°С, оптимум рН 7 –9,5
Виробничий штам повинен володіти антагоністичною активністю по відношеню до патогенних та УПМ, які використовуються при контролі пробіотиків.
3.2 Дослідження антагоністичної активності пробіотичних штамів по відношенню до стандартних тест-штамів та клінічних ізолятів
Пробіотики відіграють позитивну роль у підвищенні загальної резистентності організму, а також пригнічують УПМ. Антагоністична дія бактерій обумовлена їх високою конкурентною здатністю в процесі розмноження, що пояснюється широкою пристосованістю до умов культивування (рН, температурою). Здатність змінювати рН середовища, продукувати лізоцим і літичні ферменти являється частиною сумарного показника антагоністичної дії, яка властива бацилам, а для ентеробактерій характерне продукування мікроцинів.
Для більш повної характеристики при дослідженні штамів продуцентів, особлива увага була приділена їх взаємодії на види УПМ, збудників гострих кишкових інфекцій.
Для дослідження антагоністичної дії було використано промислові штами B.cereus IP 5832 та E.coli M17. Антагоністичну активність визначали у відношені 50 клінічних ізолятів – представників родин Enterobacteriaceae, Pseudomonadaceae, Micrococcaceae та музейних тест-культур. Дослідження проводились разом із співробітниками лабораторії загальної мікробіології КНДІЕІХ (зав. лабораторії д.м.н. Поліщук О.І.).
В таблиці 3.1 представлено результати досліджень антагоністичної дії пробіотичних штамів до стандартних тест-штамів.
Таблиця 3.1. Характеристика антагоністичної активності штамів E.coli M17 та B.cereus IP 5832 по відношеню до музейних тест-культур
| Назва музейних тест-культур | Кіль- кість штамів | Зона затримки росту тест-культур, мм | ||||
| E.coli M17 С.30202 | E.coli M17 С.51000 | E.coli M17 С.10900 | E.coli M17 С.31000 | B.cereus IP5832 | ||
| Escherichia coli | 1 | 15.2 | 16.7 | 17.5 | 10 | 15 |
| Staphylococcus aureus | 1 | 25 | 22 | 23 | 20 | 21 |
| Candida albicans | 1 | 2.8 | 2.9 | 2.7 | 2.8 | 3 |
| P.vulgaris | 1 | 12.0 | 14.0 | 14.0 | 15.0 | 13.0 |
| P.mirabilis | 2 | 10.0 | 11.0 | 9.0 | 10.0 | 8.0 |
| Shigella flexneri | 2 | 15.0 | 17.0 | 20.0 | 18.0 | 19.0 |
| Shigella sonnei | 2 | 17.0 | 18.0 | 20.0 | 18.0 | 18.0 |
В таблицях 3.2 – 3.8 представлено результати досліджень з наведенням тільки тих клінічних штамів, які виявляли активність по відношенню до певних тест-культур.
Таблиця 3.2. Характеристика антагоністичної активності штамів E.coli M17 та B.cereus IP 5832 по відношеню до клінічних тест-культур Escherichia coli
| Культура - антагоніст | Зона затримки росту тест-культур, мм | |||
| Клінічні штами | ||||
| Escherichia coli 227/1 | Escherichia coli 1705 | Escherichia coli 3394 | Escherichia coli 5873 | |
| E.coli (“Колибактерин”) С30202 | 9.0 | 11.0 | 13.0 | 9.0 |
| E.coli (“Колибактерин”) С51000 | 11.0 | 12.5 | 9.0 | 12.5 |
| E.coli (“Колибактерин”) С10900 | 12.5 | 9.0 | 13.5 | 9.5 |
| E.coli (“Колибактерин”) С31000 | 9.0 | 11.5 | 10.0 | 9.0 |
| B.cereus IP 5832 (“Бактисубтил”) | 9.0 | 10.0 | 11.0 | 10.5 |
Таблиця 3.3. Характеристика антагоністичної активності штамів E.coli M17 та B.cereus IP 5832 по відношеню до клінічних тест-культур Staphylococcus aureus
| Культура - антагоніст | Зона затримки росту тест-культур, мм | |||
| Клінічні штами | ||||
| Staphylococcus aureus 0440 | Staphylococcus aureus 1506 | Staphylococcus aureus 1661 | Staphylococcus epidermidis 1096 | |
| E.coli (“Колибактерин”) С30202 | 21.0 | 23.0 | 20.0 | 22.5 |
| E.coli (“Колибактерин”) С51000 | 22.0 | 21.5 | 19.0 | 20.5 |
| E.coli (“Колибактерин”) С10900 | 19.5 | 22.5 | 18.0 | 19.0 |
| E.coli (“Колибактерин”) С31000 | 20.0 | 21.0 | 17.5 | 23.0 |
| B.cereus IP 5832 (“Бактисубтил”) | 19.0 | 20.0 | 21.5 | 22.5 |
Таблиця 3.4. Характеристика антагоністичної активності штамів E.coli M17 та B.cereus IP 5832 по відношеню до клінічних тест-культур Klebsiella
| Культура –антагоніст | Зона затримки росту тест-культур, мм | |||
| Клінічні штами | ||||
| Klebsiella oxytoca144 | Klebsiella pneumoniae 1462 | Klebsiella pneumoniae 0362 | Klebsiella oxytoca 401 | |
| E.coli (“Колибактерин”)С30202 | 12.0 | 10.0 | 11.0 | 10.5 |
| E.coli (“Колибактерин”)С51000 | 12.5 | 11.5 | 11.0 | 11.5 |
| E.coli (“Колибактерин”)С10900 | 13.0 | 12.0 | 10.5 | 12.5 |
| E.coli (“Колибактерин”)С31000 | 11.0 | 12.5 | 11.5 | 12.0 |
| B.cereus IP 5832 (“Бактисубтил”) | 10.0 | 11.0 | 12.0 | 12.0 |
Таблиця 3.5. Характеристика антагоністичної активності штамів E.coli M17 та B.cereus IP 5832 по відношеню до клінічних тест-культур Pseudomonas aeruginosa
| Культура – антагоніст | Зона затримки росту тест-культур, мм | |||
| Клінічні штами | ||||
| Pseudomonas aeruginosa 1578 | Pseudomonas aeruginosa 433 | Pseudomonas aeruginosa 1744 | Pseudomonas aeruginosa 7/1 | |
| E.coli (“Колибактерин”) С30202 | 8.0 | 7.5 | 6.0 | 7.5 |
| E.coli (“Колибактерин”) С51000 | 7.5 | 7.0 | 6.5 | 6.0 |
| E.coli (“Колибактерин”) С10900 | 6.0 | 8.0 | 6.5 | 5.0 |
| E.coli (“Колибактерин”) С31000 | 6.5 | 6.0 | 5.5 | 6.0 |
| B.cereus IP 5832 (“Бактисубтил”) | 7.0 | 7.5 | 6.5 | 7.0 |
Таблиця 3.6. Характеристика антагоністичної активності штамів E.coli M17 та B.cereus IP 5832 по відношеню до клінічних тест-культур Enterobacter
| Культура – антагоніст | Зона затримки росту тест-культур, мм | |||
| Клінічні штами | ||||
| Enterobacter cloacae 405´ | Enterobacter cloacae 0361 | Enterobacter aerogenes 3112 | Enterobacter cloacae 5797 | |
| E.coli (“Колибактерин”) С30202 | 14.0 | 13.0 | 14.5 | 12.5 |
| E.coli (“Колибактерин”) С51000 | 13.0 | 13.0 | 12.0 | 12.5 |
| E.coli (“Колибактерин”) С10900 | 8.0 | 7.0 | 8.5 | 8.0 |
| E.coli (“Колибактерин”) С31000 | 12.0 | 11.0 | 12.5 | 11.0 |
| B.cereus IP 5832 (“Бактисубтил”) | 15.0 | 13.0 | 15.0 | 15.5 |
Таблиця 3.7. Характеристика антагоністичної активності штамів E.coli M17 та B.cereus IP 5832 по відношеню до клінічних тест-культур Proteus
| Культура – антагоніст | Зона затримки росту тест-культур, мм | |||||
| Клінічні штами | ||||||
| Proteus mirabilis 1204 | Proteus mirabilis 358 | Proteus mirabilis 2048 | Proteus vulgaris. 6349 | Proteus vulgaris. 200E | Proteus vulgaris. 1589 | |
| E.coli (“Колибактерин”) С30202 | 5.0 | 6.0 | 8. | 7.0 | 6.0 | 6.0 |
| E.coli (“Колибактерин”) С51000 | 6.0 | 7.0 | 7. | 6.0 | 5.0 | 5.0 |
| E.coli (“Колибактерин”) С10900 | 7.0 | 5.0 | 7.0 | 8.0 | 6.0 | 7.0 |
| E.coli (“Колибактерин”) С31000 | 6.0 | 6.0 | 6.0 | 7.0 | 7.0 | 5.0 |
| B.cereus IP 5832 (“Бактисубтил”) | 5.0 | 5.0 | 6.0 | 7.0 | 6.0 | 5.0 |
Таблиця 3.8. Характеристика антагоністичної активності штамів E.coli M17 та B.cereus IP 5832 по відношеню до колекційних тест-культур
| Культура – антагоніст | Зона затримки росту тест-культур, мм | |||||
| Колекційні штами | Музейні штами | |||||
| S.epiderm. 4005 | S.epiderm. Б/№ | S.epiderm. №4 | S.epiderm. 42a | E.coli 055 | E.coli 145 | |
| E.coli (“Колибактерин”) С30202 | 9.0 | 8.0 | 7.0 | 6.0 | 6.0 | 8.0 |
| E.coli (“Колибактерин”) С51000 | 10.0 | 8.0 | 6.0 | 7.0 | 5.0 | 6.0 |
| E.coli (“Колибактерин”) С10900 | 8.0 | 7.0 | 8.0 | 9.0 | 5.0 | 7.0 |
| E.coli (“Колибактерин”) С31000 | 10.0 | 11.0 | 11.0 | 10.0 | 6.0 | 7.0 |
| B.cereus IP 5832 (“Бактисубтил”) | 7.0 | 6.0 | 7.0 | 8.0 | 4.0 | 5.0 |
Розділ 4. Обговорення результатів
Представлені результати свідчать про помірну антагоністичну активність in vitro досліджених виробничих штамів.
Антагоністична активність пробіотичних препаратів “Колибактерин” та ”Бактисубтил” по відношенню до музейних культур (стандартних тест-штамів) практично не відрізнялась між собою. Найбільш високу активність E.coli M17 та B.cereus IP 5832, які входять до складу препаратів, спостерігали у відношені до музейних штамів шигел, стафілококів та протеїв (зони затримки росту цих мікроорганізмів складали 15-20 і більше мм). Менш вираженою була активність по відношенню до патогенної кишкової палички (зони затримки росту цих мікроорганізмів склали 10-15 мм).
На підставі аналізу, що представлений в таблиці 3.1., можна зробити висновок про те, що тест-культури Candida albicans, як обов`язковий тест-мікроорганізм має мінімальне пригнічення росту. З нашої точки зору це обумовлено філогенетичною стійкістю цієї культури до природних антибіотичних чинників, а також малою швидкістю росту самого мікроорганізму.
Бактеріальні тест-культури найбільш вразливі до дії речовин антибіотичної дії, що виділяються пробіотиками. Найбільш стійкими до впливу антибіотичних речовин колибактерину є культури роду Proteus, які мають мінімальні зони затримки росту 5 – 7 мм, але явно виражено приглушення роїння (рис 4.1).
Таким чином, можна говорити, що пробіотичні препарати на основі промислових штамів E.coli M17 та B.cereus IP 5832, виявляють досить широкий спектр антагоністичної активності по відношенню до музейних штамів бактерій.
Продовжуючи аналіз досліджень, можемо засвідчити, що для готових лікарських форм простежується відмінність в антагоністичній активності готових лікарських форм, що пройшли ВТК. Так для колибактерину серії 31000 простежується суттєва зміна, що може бути пов`язана із зміною умов зберігання, або порушенням технологічного процесу. Такий порівняльний аналіз є обов`язковий для оцінки ефективності готових лікарських засобів в контрольних лабораторіях МОЗ.
З метою дослідження, хоча б опосередковано, дії пробіотичних препаратів в організмі людини, вивчали антагоністичну активність препаратів на свіжевиділені клінічні штами різних родів (ентеробактерій, стафілококів), отриманих при обстеженнях дорослих хворих на туберкульоз та пієлонефрит.
Було використано 24 клінічних штами роду Shigella (S.flexneri – звичайний збудник епідемій дизентерії та гастроентерита у дітей; S.sonnei – збудник легкої форми дизентерії та літньої діареї у дітей); 26 клінічних штамів – представників патогенної та умовно патогенної мікрофлори людини (E.coli – збудник урогенітальних інфекцій та діареї у дітей; S.aureus – визиває фурункульоз, остеоміеліт, нагноювання ран та харчові отруєння; K.pneumoniae, К.oxytoca – являються збудниками госпітальних пневмоній, бактеріємії, інфекції сечовидільних шляхів, а також епідемічних діарей у новонароджених; P.aeruginosa – один із основних збудників локальних та системних гнійно-запальних процесів, особливо в умовах стаціонарів; E.cloacae – збудник гострих шлунково-кишкових захворювань; P.mirabilis, Р.vulgaris – визивають інфекцію сечовидільних шляхів у людини, а також вторинні септичні враження у паціентів із опіками та після хірургічних втручань); 4 колекційні штами (Staphylococcus epidermidis).
Активність препаратів “Колибактерин” та ”Бактисубтил” до клінічних штамів, в цілому, була нижчою в порівнянні з дією на музейні штами.
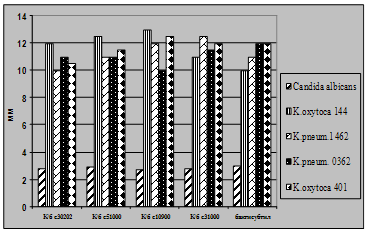
Як видно із представлених в табл. 3.2 – 3.7 даних виробничі штами E.coliM17 та B.cereus IP 5832 характеризуються вираженою антагоністичною активністю по відношенню до клінічних штамів стафілококів, ентеробактерів та кишкових паличок. Слід відмітити, що штам B.cereus IP 5832 проявляє більш виражену антагоністичну активність до клінічних ізолятів роду Enterobacter (зони затримки росту штамів становили 8 – 15 мм), в порівнянні із штамом E.coli M17 (Рис 4.2). Найбільш виражена активність пробіотичних штамів була відмічена до штамів роду Staphylococcus (Рис 4.3). Зони затримки росту стафілококів коливалися в межах 20 – 25 мм. Для клінічних штамів родів Escherichia та Klebsiella зони затримки росту складали 9 – 12 мм (Рис 4.4 та 4.5). Ще менш виражена активність була у штамів роду Pseudomonas, зони затримки росту становили 6 – 8 мм (Рис 4.6). До клінічних штамів роду Shigella (збудники дизентерії) була відмічена дуже низька антагоністична дія.
Підсумовуючи представлені in vitro результати досліджень, можна заключити, що промислові штами, які використовуються як основа для пробіотичних препаратів, мають досить високу антагоністичну активність по відношенню до широкого спектру музейних тест-штамів мікроорганізмів і дещо меншу по відношенню до клінічних штамів.
Рис 4.1. Характеристика антагоністичної активності культур E.coli M-17 та B.cereus IP 5832 по відношеню до клінічних та стандартних тест- штамів Proteus
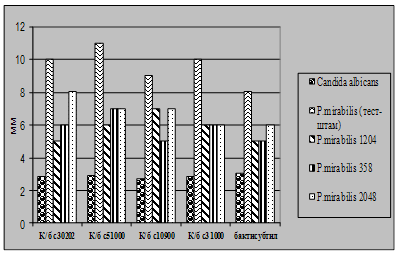
Рис 4.2. Характеристика антагоністичної активності виробничих культур E.coli M17 та B.cereus IP5832 по відношенню до клінічних штамів E.cloacae
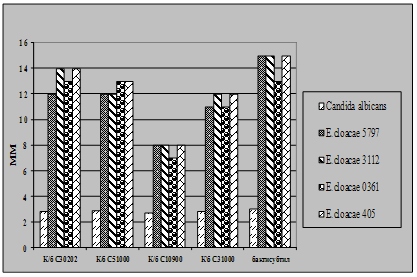
Рис 4.3. Характеристика антагоністичної активності виробничих культур E.coli M17 та B.cereus IP5832 по відношенню до клінічних та стандартних тест-штамів S.aureus
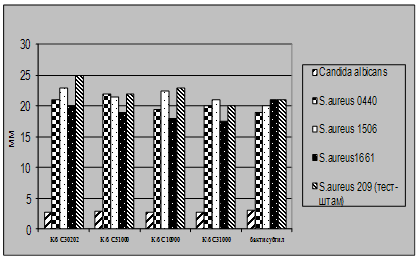
Рис 4.4. Характеристика антагоністичної активності штамів E.coli M17 та B.cereus IP 5832 по відношеню до клінічних та стандартних тест-культур E.coli
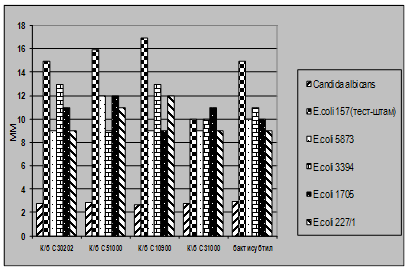
Рис 4.5. Характеристика антагоністичної активності виробничих культур E.coli M17 та B.cereus IP5832 по відношенню до клінічних штамів K.oxytoca та K.pneumoniae
Висновки
Похожие работы
... результатів. Анотація Куцик Р.В. Мікробіологічне обгрунтування нових підходів до лікування та профілактики стафілококових інфекцій на основі дослідження протимікробних властивостей похідних тіазолідину, фурану, хіноліну, акридину і біологічно активних речовин природного походження. – Рукопис. Дисертацiя на здобуття наукового ступеню доктора медичних наук за спеціальністю 03.00.07 – мі ...
... . Основний механізм резистентності Haemophilus influenzae до β-лактамних антибіотиків полягає в продукуванні β-лактамаз, які гідролізують амінопеніциліни та цефалоспорини І покоління. Решта β-лактамних антибіотиків, як правило, зберігають високу активність по відношенню до цього збудника. За даними дослідження PROTEKT, проведеного в 20 країнах світу в 2001-2006 рр., у середньому ...
... кроорганізмів або викликати їх загибель. Цілком імовірно, що і це формулювання з подальшим прогресом антибіотичної науки буде уточнюватися. В перші роки після відкриття антибіотиків їх одержували з використанням методу поверхневої ферментації. Цей метод полягав у тому, що продуцент вирощували на поверхні поживного середовища у плоских суліях (матрацах). Щоб одержати помітні кількості антибіотика, ...
... живлення, дихання, ріст і розвиток, розмноження, реакції на зовнішні подразники, пластичність, інтенсивність взаємодії з факторами середовища. Фізіологія являється науковою основою промислового використання мікроорганізмів у мікробіологічних виробництвах біологічно активних речовин (БАР), ферментів, вітамінів, антибіотиків, амінокислот, органічних кислот. Мікроорганізми здатні до синтезу ...
0 комментариев