Навигация
Анализ лекарственных веществ
3. Анализ лекарственных веществ
3.1 Химические методы анализа
Эти методы используются для установления подлинности лекарственных веществ, испытаний их на чистоту и количественного определения.
Для целей идентификации используют реакции, которые сопровождаются внешним эффектом, например изменением окраски раствора, выделением газообразных продуктов, выпадением или растворением осадков. Установление подлинности неорганических лекарственных веществ заключается в обнаружении с помощью химических реакций катионов и анионов, входящих в состав молекул. Химические реакции, применяемые для идентификации органических лекарственных веществ, основаны на использовании функционального анализа.
Чистота лекарственных веществ устанавливается с помощью чувствительных и специфичных реакций, пригодных для определения допустимых пределов содержания примесей.
Количественные методы химического анализа подразделяют на гравиметрический и титриметрическии. Гравиметрический метод основан на взвешивании осажденного вещества в виде малорастворимого соединения или отгонки органических растворителей после извлечения лекарственного вещества. Метод точен, но длителен, так как предусматривает такиеоперации, как фильтрование, промывание, высушивание (или прокаливание) до постоянной масс,ы.
Наибольшее применение получил титриметрическии метод. Название происходит от слова "титр" (фр.) — концентрация. Основная операция метода—титрование, заключающаяся в постепенном приливании к раствору анализируемого вещества титрованного раствора до точки эквивалентности. По измеренному объему титрованного раствора рассчитывают количественное содержание вещества.
Титриметрическии метод анализа получил широкое распространение потому, что он позволяет использовать разнообразные химические реакции и определять вещества, учитывая их свойства и строение. Он выполняется быстро, с большой степенью точности, не нуждается в сложном оснащении и может использоваться как в лабораториях, так и в аптеках.
Для количественного определения лекарственного вещества титриметрическим методом необходимы титрованный (стандартный) раствор, набор простой лабораторной посуды (бюретки, пипетки, мерные колбы колбы для титрования) и средств фиксации точки эквивалентности (конечной точки титрования). Последнюю фиксируют как с помощью индикаторов, так и с помощью физико-химических методов, измеряя приборами физическую константу системы (потенциометрическое, амперометрическое титрование и др. способы). Однако не всякая химическая реакция может быть применима для процесса титрования. К реакциям, используемым в титриметрическом методе, предъявляются следующие требования:
1) возможность фиксировать точку эквивалентности (конечную точку титрования);
2) количественное протекание реакции, т. е. в реакцию должно вступить 100% анализируемого вещества. Для этого необходимо строго соблюдать определенные условия титрования:
3) реакция должна протекать быстро; не допускаются побочные реакции.
3.1.1Комплексометрический метод анализа
Основан на образовании комплексного соединения. Меркуриметрия используется для определения концентрации галогенидов, тиоцианатов, цианидов с помощью титрованного раствора — нитрата ртути (II). Предложен также раствор перхлората ртути (II). Титрованные растворы готовят с добавлением соответствующих кислот. Точку эквивалентности устанавливают потенциометрически или с помощью индикатора дифенилкарбазида, образующего с избытком соли ртути (II) сине-фиолетовое соединение:
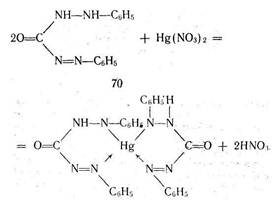
При определении йодидов в процессе титрования образуется бесцветное комплексное соединение 4KI + Hg(NO3)2= K2[HgI4] + 2KNO3.
Точку эквивалентности определяют по образованию неисчезающего красного осадка дийодида ртути (II) K2[HgI4] + Hg(NO3)2 = 2HgI2 + 2KNO3.
Йодиды можно титровать с индикатором дифенилкарбазидом, если в титруемый раствор добавить несколько миллилитров этанола. Красный осадок дийодида ртути (II) растворяется в этаноле, и тогда точку эквивалентности определяют с индикатором по появлению сине-фиолетового окрашивания. Титрование выполняется в кислой среде.
При работе с солями ртути (II) необходимо соблюдать осторожность, помнить, что растворимые соли ртути ядовиты.
К комплексиметрическому титрованию относится куприметрическое определение левомицетина. К раствору левомицетина добавляют несколько капель раствора гидроксида натрия, мурексид (как индикатор) и медленно приливают титрованный раствор сульфата меди до изменения окраски раствора из фиолетовой в коричнево-красную, сравнивая ее с окраской контрольного раствора.
При добавлении гидроксида натрия к раствору левомицетина происходит взаимодействие
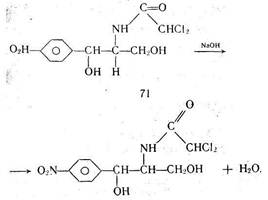
В процессе титрования образуется комплексное соединение
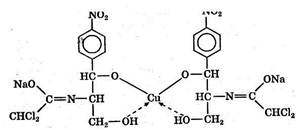
Комплексонометрический метод основан на реакции образования прочных комплексов полиаминокарбоновых кислот с ионами металлов (Са2+ , Mg2+ , Zn2+, Bi3+ и др.). Наиболее широко применяется динатриевая соль этилендиаминтетрауксусной кислоты (трилон Б). Трилон Б наряду с карбоксильными группами содержит аминный азот. Вследствие такого строения он является кислотой и комплексообразующим веществом. Многие металлы заменяют атомы водорода карбоксильных групп, одновременно связываясь координационно с азотом аминогруппы и образуя прочные комплексы трило-на Б с металлом.
Двухзарядный катион (например, Са2+) образует комплексное соединение следующего состава:
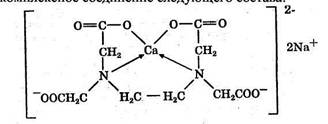
Образование комплексов можно представить схематично:
Na2H2I —> 2Na+ + H2I2
Ме2+ + H2I2 = Mel2- + 2H+
где Na2H2I— трилон Б; Me — ион металла. Как видно из приведенной схемы, реакция образования комплексов сопровождается накоплением протонов в растворе, поэтому связывание Н"1"-ионов должно способствовать образованию комплекса. Наиболее благоприятный для комплексообразования реакцией среды является рН 8—10. Поэтому титрование солей металлов трилоном Б проводят в присутствии аммиачного буфера. Для установления точки эквивалентности применяются специальные индикаторы, которые являются органическими красителями. К ним относятся кислотный хром темно-синий, кислотный хром черный специальный, называемый эриохром черный Т, мурексид, калькон-карбоновая кислота и др. Процесс комплексонометрического титрования заключается в том, что к исследуемому раствору, содержащему определяемый катион, при строго определенном значении рН прибавляют индикатор, при этом образуется хорошо растворимое в воде окрашенное комплексное соединение индикатора с ионом определяемого металла. При титровании трилоном Б этот комплекс разрушается и образуется более прочный, как правило бесцветный, комплекс иона металла с трилоном Б. При этом выделяется анион индикатора, который окрашивает раствор в цвет, присущий свободному индикатору при данном значении рН:
Ca2 + H2Ind = CaInd- + 2H+
Calnd + H2I2- = Cal2- + H2Ind
Комплексонометрическое титрование осуществляется как методом прямого, так и методом обратного титрования. Оно позволяет определять количественное содержание солей, оксидов металлов магния, кальция, цинка, свинца, висмута, ртути и др. Метод пригоден также для раздельного определения солей металлов в смеси. Раздельное определение солей кальция и магния при их совместном присутствии основано на том, что растворимость соединений титруемых солей зависит от величины рН в анализируемом растворе. Аликвотную часть раствора титруют вначале с индикатором эриохром черным при рН = 9 в присутствии аммиачного буферного раствора, причем титруются обе соли. В другой аликвотной части определяют соль кальция. В раствор добавляют несколько миллилитров 20 %-ного раствора гидроксида натрия, рН этого раствора изменяется от 9 до 12. В этих условиях соли магния осаждаются в виде гидроксида магния, и далее титруют соль кальция с индикатором мурексидом.
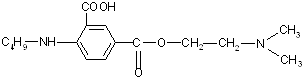
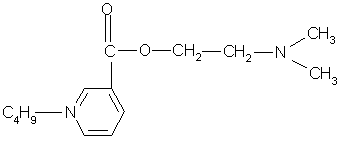
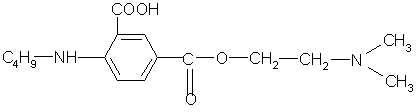
Интерес представляет косвенное комплексонометрическое определение аминопроизводных и солей органических оснований (гидрохлорида папаверина, прозерина, спазмолитина, производных фенотиазина). В этом случае используется раствор тетрароданоцинкат (П)-аммония (ТРЦ), который получают при взаимодействии тиоцианата аммония и сульфата цинка:
4NH SCN + ZnSO4 = (NH4)[Zn(SCN)4 ] + NH4SO4.
Для приготовления 0,5 М раствора ТРЦ берут 144 г сульфата цинка, помещают в мерную колбу вместимостью 1 л, добавляют 152 г. тиоцианата аммония, растворяют в воде и доводят водой до 1 л. Тщательно перемешивают, фильтруют через вату, хранят при комнатной температуре. При хранении реактива может выпасть осадок или измениться цвет. Несмотря на эти изменения, реактив годен к применению.
При добавлении реактива ТРЦ к анализируемому раствору образуется осадок комплексной соли. Например, при определении прозерина происходит осаждение его в соответствии с уравнением реакции
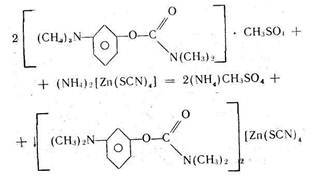
Осадок экстрагируют точно измеренным объемом хлороформа при энергичном взбалтывании в течение 2 мин н фильтруют через бумажный фильтр в сухую колбу. В колбу для титрования отбирают пипеткой определенный объем фильтрата, приливают избыток титрованного раствора трилона Б. Часть титранта вступает во взаимодействие с цинком, образуя прочное комплексное соединение. Не вошедший в реакцию титрант в присутствии аммиачного буферного раствора и индикатора хром темно-синего оттитровывают раствором сульфата цинка.
Похожие работы
... на фармакологический эффект, усложняет процесс изыскания новых Л В. Тем не менее современные методы исследования позволили определить предпосылки решения этой важной проблемы. 7 Предпосылки создания новых лекарственных веществ Изыскание новых ЛВ осуществляют различными путями. Ведущим направлением являются исследования в области модификации структуры известных природных БАВ. Одним из ...
... отдельные компоненты должны быть совместимы между собой в физико-химическом, фармакодинамическом и фармакокинетическом отношениях [8]. 1.3 Роль компьютера при создании новых лекарственных средств Ежегодно химики синтезируют, выделяют и характеризуют от 100 до 200 тысяч новых веществ. Многие из этих веществ проходят первичные испытания на выявление той или иной биологической активности. ...
... также следует учитывать при применении некоторых ЛС (например, снотворных длительного действия). Обилие лекарственных веществ, известных современной медицине, отнюдь не означает, что каждый препарат обладает индивидуальным механизмом действия. Понимание механизма действия важно не только для фармаколога, занятого поиском совершенных препаратов, но и помогает правильно использовать их в клинике. ...
... при 3000 об/мин в течение 20 мин. При этом достигается полное осаждение сывороточных белков. Надосадочную жидкость декантируют и экстрагируют из нее испытуемые вещества. Процессы экстракции анализируемых лекарственных веществ и их метаболитов из биологических объектов осуществляют с помощью таких органических растворителей, как диэтиловый эфир, хлороформ, бензол, дихлорэтан, дихлорметан, я- ...
0 комментариев