Навигация
3.1.4 Не водное титрование
Кислоты и основания в течение длительного времени определялись как вещества, которые при растворении в воде образуют соответственно ион водорода и гидроксилъный ион. Это определение, введенное Аррениусом, не учитывает того факта, что, свойства, характерные для кислот и оснований, могут проявляться также в других растворителях. Более общее определение принадлежит Брёнстеду, который рассматривает кислоту как вещество, выделяющее протоны (донор протонов), а основание как вещество, присоединяющее протоны (акцептор протонов). Еще более широкое определение дано Льюисом, считающим кислотой любое вещество, которое принимает пару электронов, а основанием — любое вещество, которое отдает пару электронов; нейтрализацию же он определяет как образование координационной связи между кислотой и основанием.
Кажущаяся сила кислоты или основания определяется степенью их реакции с растворителем. В водных растворах все сильные кислоты являются одинаково сильными, потому что они реагируют с растворителем, подвергаясь почти полному превращению в ион гидроксония (Н3О+) и кислотный анион. В слабо протофильном растворителе, например в уксусной кислоте, степень образования иона ацетония (CH3COOH2) вследствие присоединения протона обеспечивает более чувствительную дифференциацию силы кислот и показывает следующий порядок уменьшения их силы: хлорная, бромистоводородная, серная, соляная и азотная.
Уксусная кислота реагирует с водой не полностью, образуя ион гидроксония и, следовательно, является слабой кислотой. В основании, например в этилендиамине, она, напротив, реагирует с растворителем так полно, что ведет себя как сильная кислота.
Этот так называемый эффект выравнивания силы кислот наблюдается также для оснований. В серной кислоте все основания имеют также одну и ту же силу. По мере уменьшения кислотных свойств растворителя в ряду серная кислота — уксусная кислота — фенол — вода — пиридин — бутиламин, растворенные в них основания становятся "постепенно слабее и разница между ними становится более четко выряженной. В порядке уменьшения силы сильными основаниями для неводного титрования являются метилат калия, метилат натрия, метилат лития и гидроокись тетрабутиламмония.
Многие нерастроримые в поде соединения проявляют кислотные или основные свойства при растворении в органических растворителях, Таким образом, выбор подходящего растворителя позволяет определять многие такие соединения с помощью неродного титрования. Далее, в зависимости от того, какая часть соединения является физиологически активной, можно титровать эту часть путем травильного выбора растворителя и титранта. Чистые вещества можно титровать непосредственно, но часто бывает необходимо отделить активный ингредиент лекарственных форм от мешающих наполнителей и носителей.
К соединениям, которые можно титровать как кислоты относятся кислотные галогениды, ангидриды кислот, карбоновые кислоты, аминокислоты, энолы, такие, как барбитураты и ксантины, имиды, фенолы, пирролы, сульфаниламиды. К соединениям, которые можно титровать как основания, относятся амины, азотсодержащие гетероциклические соединения, четвертичные аммониевые соединения, щелочные соли органических кислот, щелочные соли неорганических кислот и некоторые соли аминов. Многие соли галоидоводородных кислот можно титровать в уксусной кислоте или уксусном ангидриде после прибавления ацетата ртути, который удаляет ион галоида переведенном в неионизированный комплекс галогенида ртути. Гидрохлориды слабых оснований, не содержащие группировок, способных ацетилироваться, можно также титровать в уксусном ангидриде без добавления ацетата ртути, используя в качестве индикатора малахитовый зеленый или кристаллический фиолетовый. Титрования, проводимые при избытке уксусного ангидрида, следует применять с осторожностью, так как любая реакция ангидрида с титруемым веществом может принести к заниженным результатам.
При титровании основных соединений обычно используют объемный раствор хлорной кислоты в ледяной уксусной кислоте, хотя в особых случаях удобнее использовать раствор хлорной кислоты в диоксане. При титровании кислых соединений часто применяют объемный раствор метилата лития в растворе метанол — толуол. Для многих случаев удобно использовать раствор гидроокиси тетрабутиламмония в толуоле; метилат натрия, ранее широко применявшийся, часто может давать вызывающий затруднения желатинообразиый осадок.
Чтобы исключить влияние углекислого газа, растворители для кислотных соединений в процессе титрования должны быть защищены от избыточного действия воздуха подходящей пробкой или инертным газом. Следует провести контрольный опыт; обычно объем 0,1 моль/л титранта не должен превышать 0,01 мл на 1 мл растворителя.
Конец титрования можно определять визуально по изменению окраски или потенциометрически. Если применяется каломельный электрод сравнения, то удобнее заменить водный раствор хлорида калия и соленом мостике на раствор перхлората лития в уксусной кислоте ИР для титрования в кислых растворителях и на раствор хлорида калия в метаноле для титрования в основных растворителях. Следует помнить, что некоторые обычно используемые индикаторы (например, кристаллический фиолетовый) подвергаются постепенному изменению окраски, поэтому при оценке пригодности метода неводного титрования для конкретного случая необходимо проследить за тем, чтобы при потенциометрическом титровании вещества изменение окраски в конечной точке титрования соответствовало максимальной величине dE/dV (где Е — электродвижущая сила, а V — объем титранта).
Если используют титранты, приготовленные с растворителями, имеющими относительно высокий коэффициент расширения (например, с ледяной уксусной кислотой, толуолом и т. п.), следует проследить за тем, чтобы были компенсированы различия в температуре между временем "применения и временем стандартизации титранта.
Похожие работы
... на фармакологический эффект, усложняет процесс изыскания новых Л В. Тем не менее современные методы исследования позволили определить предпосылки решения этой важной проблемы. 7 Предпосылки создания новых лекарственных веществ Изыскание новых ЛВ осуществляют различными путями. Ведущим направлением являются исследования в области модификации структуры известных природных БАВ. Одним из ...
... отдельные компоненты должны быть совместимы между собой в физико-химическом, фармакодинамическом и фармакокинетическом отношениях [8]. 1.3 Роль компьютера при создании новых лекарственных средств Ежегодно химики синтезируют, выделяют и характеризуют от 100 до 200 тысяч новых веществ. Многие из этих веществ проходят первичные испытания на выявление той или иной биологической активности. ...
... также следует учитывать при применении некоторых ЛС (например, снотворных длительного действия). Обилие лекарственных веществ, известных современной медицине, отнюдь не означает, что каждый препарат обладает индивидуальным механизмом действия. Понимание механизма действия важно не только для фармаколога, занятого поиском совершенных препаратов, но и помогает правильно использовать их в клинике. ...
... при 3000 об/мин в течение 20 мин. При этом достигается полное осаждение сывороточных белков. Надосадочную жидкость декантируют и экстрагируют из нее испытуемые вещества. Процессы экстракции анализируемых лекарственных веществ и их метаболитов из биологических объектов осуществляют с помощью таких органических растворителей, как диэтиловый эфир, хлороформ, бензол, дихлорэтан, дихлорметан, я- ...
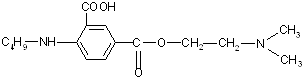
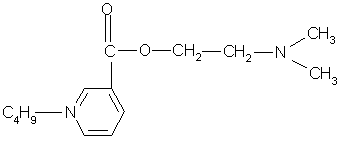
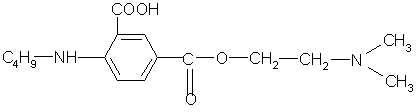
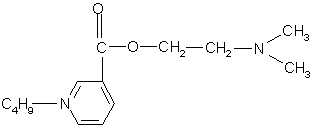
0 комментариев