Навигация
4. Культуры клеток
С появлением метода культуры тканей, позволяющего выращивать вирус в монослое клеток на стекле или пластике, клиническая вирусология достигла значительных успехов. Открытие антибиотиков, подавляющих рост бактерий и грибов, позволило ввести метод культуры ткани в повседневную практику.
В одной диагностической лаборатории нецелесообразно культивировать сразу большое количество клеточных линий, необходимых для выделения всех известных вирусов человека.
Количество клеточных линий, ведущихся в одной лаборатории, зависит от ряда факторов, прежде всего от степени доступности эмбриональной ткани, от интереса к определенным вирусам и т.д. Как правило, в оптимальное число необходимых клеточных линий должны входить: эпителиальные клеточные линии, используемые в качестве первичных или вторичных культур; перевиваемые или полуперевиваемые линии фибробластов легкого эмбриона человека или клеток линии MRC 5); перевиваемые линии эпителиальных клеток, как, например, НЕр-2 или HeLa.
Клиническую диагностику вирусов, как правило, проводят в два этапа: на первом — убеждаются в вирусной природе заболевания, на втором — идентифицируют вирус. Чаще всего вирус обнаруживают по ЦПД. При некоторых заболеваниях для постановки предварительного диагноза достаточно располагать сведениями о ЦПД и клинической картине заболевания. Так, например, во многих лабораториях, где проводят заражение фибробластов материалом, полученным с генитального мазка, указывают, что «обнаружены признаки ЦПД, характерные для вируса простого герпеса». При этом последующую формальную идентификацию вируса не проводят. В других случаях признаки ЦПД характеризуют большую группу вирусов, например энте-ровирусов 67 типов. Здесь постановка более точного диагноза будет зависеть от результатов реакции нейтрализации вируса специфическими антисыворотками. Последняя процедура требует много времени, поэтому возможны промежуточные сообщения, например «выделены энтеровирусы, необходима дальнейшая идентификация».
Некоторые вирусы, например миксо- и парамиксовирусы, обычно не вызывают заметного ЦПД, однако изменяют поверхность культивируемых клеток таким образом, что последние начинают связывать эритроциты. Клинический материал инкубируют с клетками монослойной культуры, на которую затем наносят суспензию эритроцитов. После инкубации с эритроцитами культуры тщательно промывают и учитывают результаты. Дальнейшую идентификацию проводят с помощью реакции торможения гемадсорбции специфическими антисыворотками. Некоторые из указанных выше вирусов продуцируют растворимый гемагглютинин, поэтому их идентифицируют методом торможения гемагглютинации.
Другие вирусы идентифицируют методом непрямой иммуно-флуоресценции. Подобным образом определяют и РСВ. Однако в тех случаях, когда клинические симптомы и характер ЦПД не позволяют отнести вирус к той или иной группе, необходимо исследовать клеточный гомогенат под электронным микроскопом. Подобным образом время от времени следует исследовать и клеточные культуры, используемые в рутинной работе, для исключения случайной вирусной инфекции.
В табл. 2 представлены основные группы болезнетворных вирусов, клеточные линии для их выделения, а также способы выявления и идентификации.
Таблица 2. Чувствительные клеточные линии, способы выявления и идентификации наиболее распространенных вирусов, вызывающих заболевания человека
| Вирусы | Чувствительная клеточная линия | Выявление и идентификация |
| Аденовирусы Вирус Коксаки А Вирус Коксаки В Цитомегаловирус Эховирусы Вирус простого герпеса Вирус гриппа А и В Вирус кори Вирус свинки Вирус парагриппа Полиовирусы Респираторно-синцитиальный вирус Риновирусы Вирус краснухи Вирус ветрянки | пэч ГШ» пп ФЛЭЧ пп ФЛЭЧ пп пп, пэч пп пп пп Нер-2 ФЛЭЧ RK-13 ФЛЭЧ | ЦПД, НТ ЦПД, НТ ЦПД, НТ ЦПД, ЦПД, НТ ЦПД, НТ, ИФ ГА, ТГА, ИФ ЦПД, НТ, ИФ ГА, ТГА ГА, ТГА, ИФ ЦПД, НТ ЦПД, НТ, ИФ ЦПД, НТ ЦПД, НТ, ИФ ЦПД |
5. Иммунологические методы
Существует множество методов качественного и количественного определения вирусоспецифических антител. С помощью этих методов можно обнаружить как IgM и IgG одновременно, так и отдельно иммуноглобулины каждого класса. Как правило, в реакции связывания комплемента выявляются только вирусоспеци-фические IgG. Однако при тестировании этим методом микробиологических антигенов возможно одновременное определение специфических IgM и IgG.
Иммунологические методы используются главным образом в двух целях: во-первых, для диагностики текущей, завершившейся или врожденной вирусной инфекции и, во-вторых, для обнаружения специфических антител, присутствие которых указывает на прошедшую инфекцию и, следовательно, на иммунитет к возможной повторной инфекции. По силе иммунного ответа на вирусную инфекцию люди сильно отличаются друг от друга. На рис. 3 показана типичная кривая нарастания титра
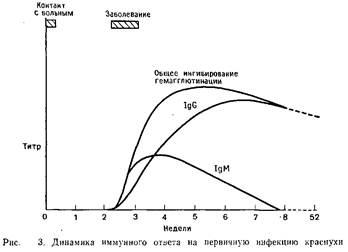
антител в ответ на первичную инфекцию краснухи. Легко заметить, что установление диагноза краснухи возможно по нарастанию титра специфических IgG и выявлению специфических IgM. Присутствие специфических IgM в крови новорожденного свидетельствует о внутриматочном инфицировании, поскольку материнские IgM в отличие от IgG задерживаются плацентой. Специфические IgG, образовавшиеся в результате первичной инфекции, обычно сохраняются в течение всей жизни. Поэтому присутствие антител этого класса в сыворотке крови свидетельствует об иммунитете к соответствующей повторной инфекции.
Ниже приведены иммунологические методы обнаружения специфических антител к вирусу краснухи, особенно эффективные для диагностики заболевания плода и определения титра специфических антител в сыворотке крови. Подробные описания методов, используемых для диагностики краснухи, можно найти в обзорах Паттисона и Моргана-Капнера.
5.1 Реакция торможения гемагглютинации
Вирус краснухи вызывает гемагглютинацию эритроцитов многих видов животных. Чаще всего в РТГА используют эритроциты однодневных цыплят. Гемагглютинирующим антигеном вируса краснухи при постановке этой реакции служит выращенный в культуре и обработанный Твин 80 и эфиром вирус. Предварительная обработка увеличивает ГА-титр вируса.
5.1.1 Стандартизация ГА-антигена вируса краснухи
1. 1 мл 50%-ной суспензии эритроцитов цыплят трижды промывают в вероналовом буфере с декстраном и желатином центрифугированием и ресуспендированием осадка в 15-мл градуированной центрифужной пробирке. Отмытые клетки ресуспендируют в DGV-буфере для получения 30%-ной суспензии.
Таблица 3. Приготовление вероналового буфера с декстраном и желатином
| 1. DGV-буферный раствор Таблетки буфера для реакции 20 связывания комплемента Веронал натрия 400 мг Желатин 1200 мг Дистиллированная вода 2000 мл Растворяют таблетки в дистиллированной воде. Добавляют веронал натрия и желатин. Помещают в водяную баню при 56 °С до полного растворения желатина. Разливают во флаконы по 100 мл. Автоклавируют и хранят при 4 °С |
| 2. 25%-ный БСА БСА, фракция 5 25 г Стерильная дистиллированная 100 мл вода Стерилизуют фильтрованием, разливают по 1 мл в стерильные ампулы. Хранят при —20 "С |
| 3. 10%-ная глюкоза Глюкоза 10 г Дистиллированная вода 100 мл Разливают по 1 мл. Автоклавируют и хранят при 4 °С |
| 4. Для использования DGV-буферный раствор 100 мл 25%-ный БСА 0,8 мл 10%-ная глюкоза 1,0 мл Хранят при 4°С |
2. Разводят лиофилизированный препарат ГА-антигена вируса краснухи в требуемом по инструкции объеме дистиллированной воды.
3. В каждую из восьми лунок двух соседних рядов 96-луноч-ного полистиролового планшета для микротитрования с U-об-разными лунками вносят по 1 объему DGV.
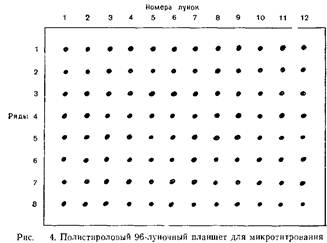
4. В первые лунки двух рядов вносят по одному объему ГА-антигена вируса краснухи.
5. Готовят последовательные двукратные разведения ГА-антигена вируса краснухи, начиная от 1:2 и до 1:256, используя 0,025-мл микротитратор. Перед употреблением головку микро-титратора следует прокалить в пламени докрасна, затем остудить в течение нескольких секунд, поместить в дистиллированную воду и промакнуть фильтровальной бумагой.
6. В каждую из заполненных лунок дополнительно вносят по одному объему DGV-буфера. В качестве контроля в лунки 12 первых двух рядов вносят по два объема DGV-буфера.
7. Суспензию отмытых эритроцитов цыплят разводят в 100 раз DGV-буфером, получая таким образом 0,03%-ную суспензию.
8. Во все 18 лунок добавляют по два объема 0,03%-ной суспензии эритроцитов, готовый планшет закрывают другим, неиспользованным планшетом и инкубируют 1 ч при 4 °С.
9. На дне контрольных лунок образуется плотная «бляшка» неагглютинированных эритроцитов. Агглютинированные эритроциты оседают равномерно. ГА-титром считают обратную величину наибольшего разведения ГА-антигена вируса краснухи, при котором еще происходит полная агглютинация. Такое разведение содержит 1 гемагглютинирующую единицу.
Для тестирования сывороток используют 4 ГА-единицы антигена вируса краснухи. Таким образом, если ГА-титр антигена равняется 32, то для обнаружения антител к вирусу краснухи его разводят DGV в восемь раз. Разведенный антиген стабилен в течение 25—48 ч при 4 °С.
5.1.2 Предварительная обработка сыворотки
Все сыворотки содержат неспецифические ингибиторы гемаг-глютинации, которые следует удалить. Неспецифические ингибиторы ГА в основном представляют собой липопротеины, от которых освобождаются, обрабатывая сыворотку каолином. В сыворотках человека, кроме того, могут присутствовать неспецифические агглютинины куриных эритроцитов. Однако предварительная адсорбция тестируемых сывороток эритроцитами не является обязательной, поскольку все неспецифические гемагглютинины, присутствующие в сыворотках, обнаруживаются в контролях.
1. В стеклянные пронумерованные пробирки вносят по 0,2 мл сыворотки. Кроме исследуемых сывороток в каждом опыте необходимы положительные и отрицательные контроли.
2. В каждую пробирку добавляют по 0,8 мл 25%-ного каолина на боратно-солевом буфере.
3. Содержимое пробирок взбалтывают и оставляют при комнатной температуре на 20 мин.
4. Отработанный каолин осаждают центрифугированием в настольной центрифуге при 2000 об/мин 20 мин.
5. Супернатант переносят в чистые пронумерованные пробирки. В результате очистки получают сыворотки, разбавленные в четыре раза. Их используют для постановки реакции торможения гемагглютинации. Сыворотки можно хранить при 4 °С в течение ночи.
5.1.3 Реакция торможения гемагглютинации
1. Для тестирования одного образца сыворотки вносят по одному объему DGV в один ряд лунок.
2. В первую и последнюю лунки добавляют по одному объему сыворотки, разведенной в четыре раза.
3. С помощью микротитратора готовят последовательные двукратные разведения сыворотки.
4. В лунки 1—10 вносят по одному объему ГА-антигена краснухи, содержащего 4 ГАЕ. В лунку 12 ГА-антиген краснухи не добавляют.
5. В лунки 1—8 другого планшета вносят по одному объему рабочего разведения ГА-антигена краснухи, и затем в восьми лунках готовят последовательные двукратные разведения ГА-антигена. В эти 16 лунок добавляют по одному объему DGV. Это титрование является проверочным для ГА-антигена краснухи. Для контроля в лунки 12 первого и второго рядов вносят по два объема DGV.
6. Закрытые планшеты оставляют на 1 ч при комнатной температуре или на ночь при 4 °С.
7. Во все заполненные лунки вносят по два объема 0,03%-ной суспензии эритроцитов цыплят и планшеты оставляют на 1 — 1,5 ч при 4 °С.
8. Просматривая планшеты, определяют титр ГА-антигена краснухи. В контрольных лунках агглютинация не должна произойти.
9. Если же сыворотка агглютинировала эритроциты в отсутствие ГА-антигена краснухи, необходимо провести повторное тестирование исходного разведения сыворотки. Перед этим сыворотку адсорбируют одной каплей 30%-ной суспензии эритроцитов цыплят 1 ч при комнатной температуре, а затем эритроциты осаждают центрифугированием.
10. Титром специфических антител в исследуемой сыворотке считают обратную величину разведения, при котором полностью подавляется гемагглютинация.
5.1.4 Интерпретация результатов
При невысоком титре интерпретировать результаты сложно, так как при небольшом разведении возможно остаточное присутствие неспецифических ингибиторов. Наличие вирусоспецифических антител считается доказанным при титре 16 или выше.
Похожие работы
екул ДНК на матрице молекулы РНК. За это открытие они получили Нобелевскую премию. Д.И. Ивановский по праву считается основателем науки вирусология. Д.И. Ивановский открыл вирусы – новую форму существования жизни. Своими исследованиями он заложил основы ряда научных направлений вирусологии: изучение природы вирусов, цитопатология вирусных инфекций, фильтрующихся форм микроорганизмов, ...
... авторы с успехом применяли этот метод при изучении различных вирусов — ящура, везикулярного стоматита, ньюкаслской болезни, чумы птиц, полиомиелита, Коксаки и др. Метод бляшек стали широко применять в вирусологии для получения чистых популяций вируса, особенно при изучении их генетических свойств. Методику получения бляшек, предложенную Дальбекко и Фогтом, модифицировали, и в настоящее время есть ...
... JgD являются аутоиммунными антителами, так как при аутоиммунных заболеваниях (например, красная волчанка) их количество в сыворотке крови больных увеличивается в сотни раз. Раздел «Частная микробиология и вирусология» Вопрос 6. Возбудитель холеры: биологическая характеристика, среда обитания, источники, пути и механизмы инфицирования; факторы патогенности; принципы лабораторной диагностики; ...
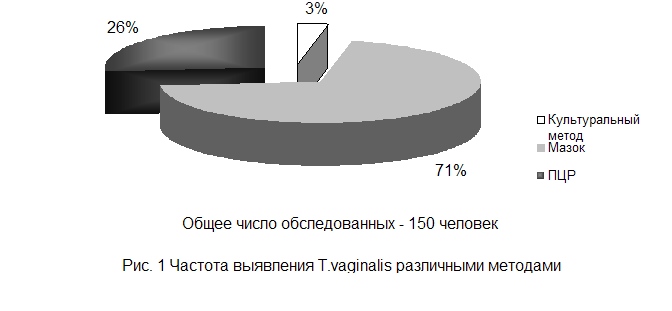
... простатитом, тогда как при острых уретритах обнаруживают мало паразитов - в основном атипичные амебоидные формы[7,10,14,15,19]. 1.4.2 Культуральное исследование Служит важным звеном лабораторной диагностики трихомоноза у мужчин и женщин, особенно при распознавании атипичных форм паразитов и выявлении их у лиц, получавших противотрихомонадные препараты при трихомонадоносительстве. ...


0 комментариев