Навигация
Синтез аминазина
5.2.1 Синтез аминазина
2-Хлорфенотиазин – основной полупродукт синтеза ценного и широко применяемого лечебного препарата аминазина [19]. Кроме того, он является основным полупродуктом синтеза другого лечебного препарата – хлорацизина, применяемого при лечении заболеваний сердечно-сосудистой системы.
Наиболее рациональноной схемой получения 2-хлорфенотиазина является конденсация 3-хлордифениламина с серой (сплавление) в присутствии йода.

Реакция протекает с образованием двух изомерных хлорфенотиазинов – 2-хлорфенотиазина и 4-хлорфенотиазина.
Впервые эта реакция описана Шарпантье и Жолио. Авторы проводили конденсацию при небольшом избытке серы в присутствии 1 % йода при 180°С. Они приводят данные о температуре плавления образующихся продуктов без описания метода разделения и указания выхода 2-хлорфенотиазина.
Н. В. Савицкая и соавторы разработали условия конденсации 3-хлордифениламина с серой и очистки плава хлорфенотиазина. Реакцию 3-хлордифениламина с небольшим (2 % теоретического количества) избытком серы проводят в присутствии йода (1 % веса 3-хлордифениламина). Реакционную массу нагревают до 175–180°С и выдерживают при этой температуре до прекращения выделения сероводорода. Плав после кипячения в хлорбензоле с активированным углем фильтруют. Выкристаллизовавшийся и отфильтрованный хлорфенотиазин промывают хлорбензолом и спиртом. Выход 2-хлорфенотиазина составляет 56,2 %, считая на 3-хлордифениламин. Температура плавления 2-хлорфенотиазина 191–194°С.
В производстве аминазина получение 2-хлорфенотиазина является наиболее трудным процессом, что обуловлено относительно высокой температурой сплавления (175–180°С), образованием изомера – 4-хлорфенотиазина, смолистых веществ и выделением больших количеств сероводорода. В производственных условиях в силу ряда причин осмоление более значительно, чем в лабораторных условиях, поэтому даже сравнительно невысокий выход 2-хлорфенотиазина (56 %) в производстве практически не достигается.
Все эти обстоятельства заставили нас искать путей смещения равновесия реакции с целью повышения выхода 2-хлорфенотиазина. Попытки вести реакцию в каких-либо наиболее доступных и обычно применяемых органических растворителях не привели к положительным результатам. Лучшей средой для ведения реакции оказалось само основное вещество – 3-хлордифениламин. Мы установили, что проведение реакции 3-хлордифениламина с серой при избытке 3-хлордифениламина и в присутствии остатка после отделения 2-хлорфенотиазина, содержащего главным образом 4-хлорфенотоазин, смещает реакцию в сторону преомущественного образования 2-хлорфенотиазина.
Экспериментальная часть
В трехгорловую круглодонную колбу, снабженную мешалкой и термометром, помещают 100 г перегнанного 3-хлордифениламина (0,49 г/м), 20 г серы (0,31 г/м) и 1 г йода (0,005 г/м). Полученную смесь нагревают при перемешивании до 170–180°С и выдерживают при этой температуре до прекращения выделения сероводорода (1 – 1½ часа). По окончании выдержки к реакциовной массе прибавляют 175 мл хлорбензола и 5 г угля, кипятят в течение 15 минут (130–132°С) и затем фильтруют горячий раствор, освобождая его от угля и смолистых примесей. Фильтрат охлаждают до 5–10°С и оставляют на 3–4 часа для кристаллизации. Вьипавший осадок 2-хлорфенотиазина отфильтровывают, промывают небольшим количеством хлорбензола и этилового спирта и сушат при 100°С. Получают 42–45 г 2-хлорфенотиазина с температурой плавления 195–200°С (в пределах 1°С).
От маточного раствора после отделения 2-хлорфенотиазина отгоняют спирт и хлорбензол, к остатку прибавляют 32 г 3-хлордифениламина, 10 г серы и 0,5 г йода и повторяют синтез, как описано выше. Подобным же образом поступают с остатками после отделения 2-хлорфенотиазина в последующих 9–10 опытах с той только разницей, что нагревают до 175–180°, а не до 150–160°, как в первых двух опытах.
В итоге при употреблении в цикле из 11 опытов 420 г 3-хлордифенил-амина получают 380 г 2-хлорфенотиазина, что составляет 79 % теоретического выхода, считая на израсходованный 3-хлордофениламин.
Количество 3-хлордифениламина (32 г) во втором и последующих опытах определяется весом получаемых остатков после отделения 2-хлорфенотиазина с учетом того, чтобы сумма веса 3-хлордифениламина и остатка была близка к первоначальной загрузке, т. е. к 100 г.
Поскольку в цикле находится избыток 3-хлордифениламина, количество взятой серы близко к теоретическому (по отношению к вновь загружаемому 3-хлордифениламину).
Вес остатка не увеличивается с увеличением числа проведенных опытов, что подтверждает предположение о смещении равновесия реакции в сторону образования 2-хлорфенотиазина, когда в остатке уже имеется изомер 4-хлорфенотиазин, так как вновь загружаемый 3-хлордифениламин расходуется главным образом на образование 2-хлорфенотиазина, иначе с увеличением числа проведенных опытов должен был бы существенно увеличиваться вес остатка.
Рециркуляция остатка длится до тех пор, пока не истощится избыток 3-хлордифениламина. При 10-й рециркуляции остатка 2-хлорфенотиазин имеет точку плавления 193–194°С, окраска хлорфенотиазина темно-зеленаяж. Дальнейшая рециркуляция уже нецелесообразна, так как наступает еще более резкое понижение качества.
Мы провели серию опытов, в которой, начиная с 3-го опыта, брали по 35 г 3-хлордифениламина т. е. на 10 % больше, чем в предыдущих опытах. В этом случае удалось вести рециркуляцию остатка до 20-го опыта, но выход остался на прежнем уровне (77 %). Поэтому соотношение компонентов реакции в первой серии опытов следует считать наиболее рациональным.
Описанный способ позволяет получать 2-хлорфенотиазии высокого качества, с температурой плавления 195–200°С (в пределах 1°С) и выходом 79 % теоретического, считая на 3-хлордифениламин.
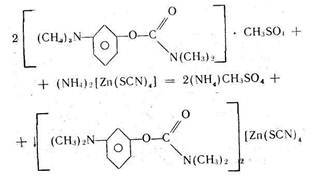
Заключительной стадией в синтезе аминазина (I*HCl) является алкилирование 2-хлорфенотиазина (II) диметиламинохлорпропаном (III) [20]. Подобран оптимальный режим процесса: реагенты II и III кипятят в смеси толуола с хлорбензолом в присутствии порошкообразного едкого натра, причем выход I достигает 90 %. Проведение реакции аналогичным образом, но в присутствии катализатора межфазного переноса (КМФ) не дает очевидных преимуществ; выход I составляет 78 %. В более мягких условиях, типичных для реакции межфазного переноса (80°С, 25 мол.% КМФ, бензол/водный раствор NaOH) соединение I получить не удалось, хотя в тех же условиях фенотиазин II алкилируется хлористым бензилом и бромистым этилом. Низкая эффективность III как алкилирующего агента была отмечена, но не получила объяснения.

I: R = (CH2)3NMe; II: R = H; IV: R = CH2Ph; V: R = Me; VII: R = CH2CH=CH2
Экспериментальная часть
ГЖХ-анализы проведены на хроматографах «Varian-3700» (США) и «Chrom-5» (ЧССР) с пламенно-ионизационным детектором; колонки стеклянные или стальные (100×0,3 см), заполненные сорбентом (5% OV-17) на хроматоне «N-super». Замена стеклянных колонок на металлические, а также изменение температуры испарителя (210–350°С) не приводит к термокаталитическому разложению основания аминазина I: на хроматограммах не меняется соотношение пиков и не появляются дополнительные пики. Режим анализа: температура анализа колонок 210°С, испарителя 250°С, детектора 250°С, скорость газа-носителя (азот) 30 мл/мин, время удерживания веществ V, VII и I 3, 3,8 и 7 соответственно.
Масс-спектры электронного удара получены на хромато-масс-спектрометре МАТ-112 («Varian», ФРГ), энергия ионизирующих электронов 70 эВ. Ввод образца реакционной массы осуществлялся через хроматограф «Varian Aerograph 1440»; колонки и режим их работы такие же, как и при ГЖХ-анализе.
Гидрохлорид 2-хлор-10-(γ-диметиламинопропил)-фенотиазина (I*HCl) и 2-хлор-10-метилфенотиазин (V). Реакцию II (0,05 моль) и III проводят согласно [1], продолжительность отгонки воды 4,5 ч. Далее реакционную смесь промывают водой, смесь растворителей отгоняют в вакууме, остаток сушат до постоянной массы (16,13 г) и анализируют методом ГЖХ.
Полученную смесь растворяют в 70 мл толуола, прибавляют раствор HCl в этаноле, раствор упаривают в вакууме до объема 30 мл, выпавшие кристаллы отфильтровывают и после перекристаллизации из смеси толуол–изопропиловый спирт (4:1) получают 10,92 г I*HCl (61,4%).
Маточный раствор после отделения технического I*HCl промывают водой, толуол отгоняют, остаток тщательно сушат в вакууме и анализируют на хромато-масс-спектрометре. Масс-спектр m/z (IОТН): V – 247(100), 232(65), 215(12), 212(19); VII – 273(11), 247(8), 233(95), 232(100), 198(39). После двух перекристаллизаций из гексана получают 0,1 г V, т.пл. 81–83°С.
Похожие работы
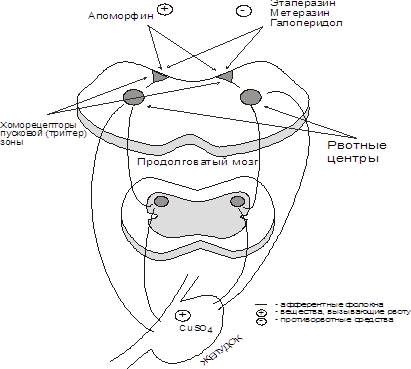
... рефлекторного характера. Однако практическое применение их ограничено, так как они действуют раздражающе на слизистую желудка и могут вызвать общетоксичекое действие. 3.2. ПРОТИВОРВОТНЫЕ СРЕДСТВА Если рвотные средства в настоящее время применяются редко, то борьба с рвотой, изнуряющей и обезвоживающей организм, необходимо довольно часто. Механизм рвотного акта обязательно должен учитываться ...
... порядке для применения с целью лечения, предупреждения или диагностики заболевания у человека или животного. Лекарственные средства можно классифицировать по следующим принципам: – терапевтическое применение (противоопухолевые, антиангинальные, противомикробные средства); ...
... , согласованного с национальными органами управления здравоохранением. В Российской федерации гомеопатические препараты подлежат такому же законодательному регулированию как и обычные лекарства. 2. Свойства лекарственных веществ Средства для наркоза. Для общего обезболивания в современной анестезиологии применяют различные лекарственные средства. В процессе подготовки к операции проводится ...
Бензоклидина гидрохлорид (оксилидин) Бенактизин (амизил) -пр. дифенилметана Темпидин - в составе темпалгина ------------------------------------------------------------------------------ СЕДАТИВНЫЕ ПРЕПАРАТЫ(I.) ПРЕПАРАТЫ БРОМА (в микстурах): Натрия бромид Калия бромид Бромкамфора Бромизовал (бромурал)(II.) РАСТИТЕЛЬНЫЕ ПРЕПАРАТЫ: Валерианы ...
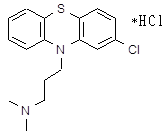

0 комментариев