Навигация
ФЕРМЕНТАТИВНАЯ АКТИВНОСТЬ
3.5 ФЕРМЕНТАТИВНАЯ АКТИВНОСТЬ
Одним из наиболее важных методов характеристики очищенных мембранных белков несомненно является определение биохимической активности. При этом используются в основном такие же критерии, как и для растворимых белков, но могут возникать и свои трудности. Первая из них связана с тем, что биохимическая активность мембранных белков часто очень сильно зависит от связывания с белком липидов и детергентов. Потеря активности может быть как обратимой, так и необратимой. Целесообразно иметь какую-то оценку удельной активности исследуемого белка in vivo или в составе мембран до солюбилизации. Избыток детергента может оказывать ингибирующий эффект, например за счет разбавления неполярных субстратов в популяции мицелл и уменьшения ферментативной активности. Измеряя активность любого мембранного белка, необходимо иметь в виду, что in situ он находится в окружении липидов, обеспечивающих оптимальную активность. Вторая проблема связана с белками, обладающими «трансбислойной» активностью; примерами могут служить белки, образующие каналы, и транспортные белки. В этих случаях необходимо учитывать перемещение растворенных веществ из одного компартмента в другой.
3.6 ЧЕТВЕРТИЧНАЯ СТРУКТУРА И ХИМИЧЕСКОЕ СШИВАНИЕ
Многие мембранные ферменты представляют собой комплексы, состоящие из нескольких субъединиц. В качестве примера можно привести Н + -АТРазу, Na + /К +-АТРазу, митохондриальные комплексы электронного транспорта и фотосинтетические реакционные центры. Некоторые интегральные мембранные белки прочно связаны с растворимыми белками с помощью нековалентных взаимодействий. В Е. coli Fo-компонент, содержащий по данным электрофореза в ПААГ-ДСН три типа субъединиц, образует протонный канал, a Fi, состоящий из пяти типов субъединиц, содержит активный центр, участвующий в гидролизе АТР. Для таких белков очень важно определить характер субъединиц, стехиометрию комплекса и ближайшие взаимодействия его компонентов. Это весьма непростая задача даже тогда, когда белковый комплекс уже изолирован. Возникающие здесь проблемы по существу не отличаются от таковых для растворимых белковых комплексов, но имеются и свои дополнительные сложности.
Прежде всего следует иметь в виду, что взаимодействие между субъеднницами очень сильно зависит от типа липидов и детергентов, с которыми связаны белки. Например, сукцинатде-гидрогеназа Е. coli при солюбилизации ее с помощью луброла РХ представляется состоящей из четырех субъединиц, а при солюбилизации большинством других детергентов, в том числе тритоном Х-100, — только из двух. Известно, что оперон sdh кодирует все четыре полипептида, а форма из двух субъединиц имеет аномальный спектр ЭПР. Таким образом, ясно, что in vivo фермент состоит из четырех субъединиц. Однако сукцинатдегидрогеназной активностью обладают обе формы, поэтому используемые биохимические критерии важны для заключения, была ли солюбилизирована правильная форма.
Еще одна проблема связана с тем, что в бислое мембранные белки могут образовывать комплексы из-за высокой их локальной концентрации. При солюбилизации же независимо от используемого детергента может произойти разбавление мембранных белков и их разъединение. По закону действующих масс это приведет к диссоциации комплексов, в которых взаимодействие между компонентами не очень сильное. Часто бывает трудно определить, какой комплекс образуется in situ, а какой — прн солюбилизации и очистке. Подобные проблемы возникают при исследовании многих сложных систем, например системы /3-адренергетический рецептор—адеиилатци-клаза, цепи электронного транспорта у митохондрий, системы мик-Росомных цитохромов Р450 и b$.
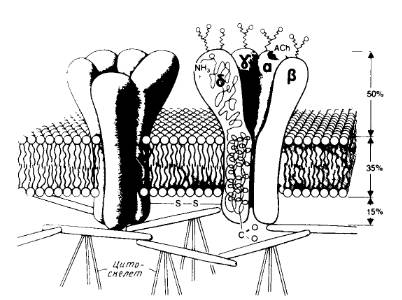
Для изучения стехиометрии субъединиц и их ассоциации в очищенном комплексе используется всего несколько методов: 1) химичес кое сшивание; 2) количественный анализ N-концевых аминокислот; 3) определение отношения массы субъединиц в ДСН-полиакриламидных гелях путем определения интенсивности окрашивания, с помощью радиоавтографии или иммуноблоттинга. Каждый метод имеет свои ограничения, но все они использовались на практике. Например, стехиометрию пяти субъединиц никотинового ацетил-холииового рецептора определяли с помощью количественного анализа N-коицевых аминокислот, а трех субъедиииц Fo-компоиента Н + -АТРазы Е. coli — с помощью разделения в ДСН-полиакриламидных гелях. Заметим, что кумасси бриллиантовый синий, обычно используемый для окрашивания белков после разделения в ПААГ-ДСН, связывается предпочтительнее с белками, содержащими основные аминокислотные остатки, и существуют примеры сильно неполярных внутренних мембранных белков, которые лишь едва окрашиваются.
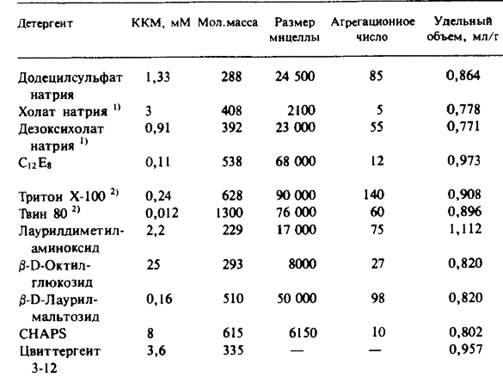
Химическое сшивание применялось для определения ближних взаимодействий как в очищенных белковых комплексах, так и в комплексах in situ. Для анализа ближних взаимодействий в мембранных белках используется несколько специфических гидрофобных сшивающих агентов. Некоторые из них представлены в табл. 3.4. Применяемые методы не отличаются от таковых для растворимых систем. Продукты сшивания обычно анализируют с помощью электрофореза в ПААГ, часто с использованием расщепляемых сшивающих агентов, что позволяет анализировать полипептиды. Применяют также антитела к индивидуальным полипептидам для иммуноблоттинга после электрофореза в ПААГ-ДСН, чтобы идентифицировать компоненты каждого из образовавшихся продуктов. Можно было бы предположить, что при относительно большом времени жизни реагентов белки в биомембранах будут сшиваться в результате простой диффузии в бислое. Однако, по данным нескольких работ, это не так: продукты сшивания представляют собой специфические белковые ассоциаты, а не случайные образования. Так, в фотосинтетической мембране Rhodobacter capsulata образуются сшивки лишь между субъединицами компонентов реакционного центра, а также между реакционным центром и «антенным» комплексом В870, участвующим в передаче энергии реакционному центру.
И наконец, отметим, что химическое сшивание часто использовалось для идентификации интегральных мембранных белков, которые связываются с известными растворимыми компонентами. В качестве примера можно привести сшивание 1) а- и b-субъединиц Fo-kom-понента Н + -АТРазы с /3-субъединицей растворимого компонента Fi; 2) цитохрома с с субъединицами митохондриальной цитохром с-оксидазы; 3) пептидных гормонов с рецепторами гормонов.
Таблица 4. Некоторые сшивающие реагенты, использовавшиеся для определения четвертичной структуры мембранных белков "

Похожие работы
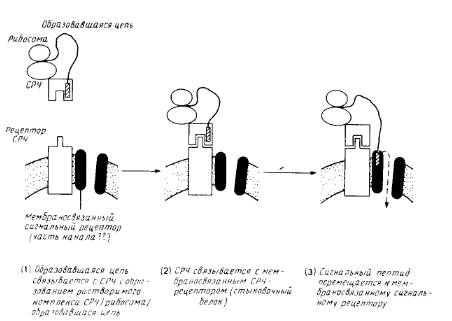
... . О предполагаемом канале, участвующем в переносе, ничего неизвестно; очистка его является довольно сложной задачей. 5. Сборка мультисубъединичных комплексов и обновление мембранных белков После встраивания мембранного полипептида в мембрану он еще должен приобрести правильную конформацию, обеспечивающую его биологическую активность, а если речь идет о мультисубъединичных комплексах, то ...
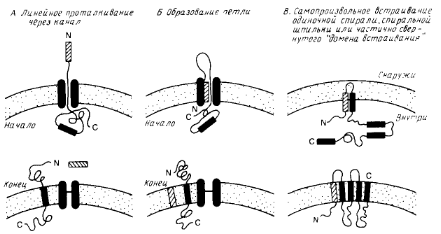
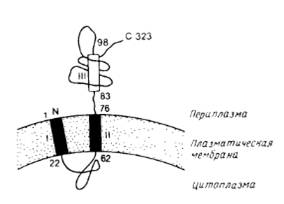
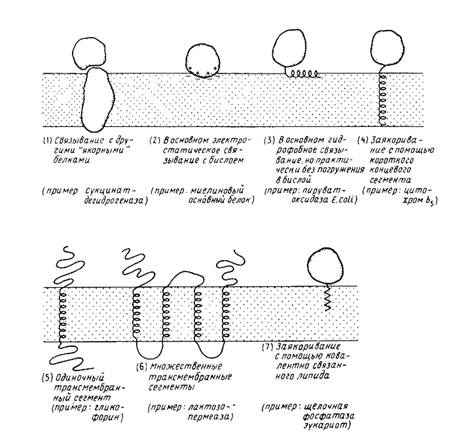
... на N-, либо на С-конце молекулы. N – и С-концы трансмембранных белков (5 и 6) могут находиться как у наружной, так и у внутренней поверхности мембраны. 2. Выделение мембранных белков Очистка и характеристика мембранных белков ставят перед исследователем целый ряд специфических проблем, с которыми он обычно не сталкивается, работая с растворимыми белками. Мембранные белки, как правило, ...
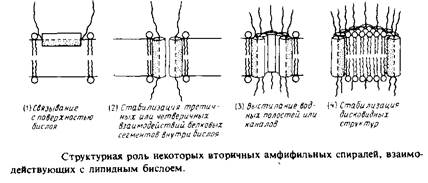
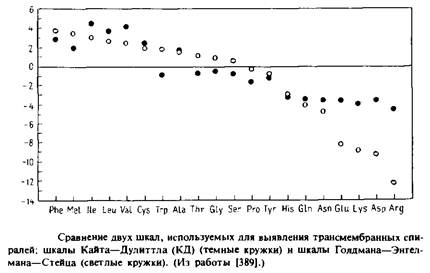
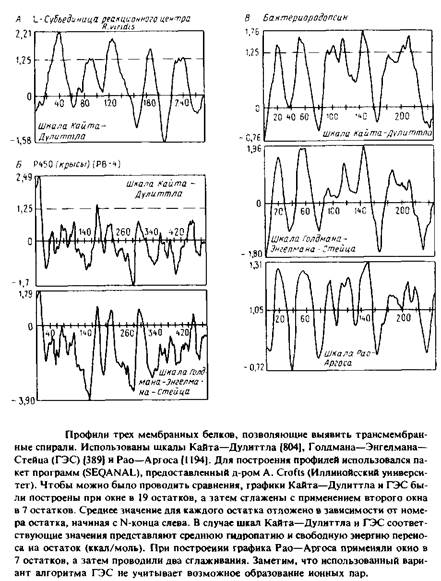
... внутри бислоя могло бы стабилизировать трехмерную структуру мембранных белков. Способы идентификации первичных амфифильных структур Однозначная структурная информация о мембранных белках получена лишь в нескольких случаях, но зато в распоряжении исследователей имеются обширные данные об аминокислотной последовательности, основанные на результатах секвенирования ДНК. Для идентификации ...
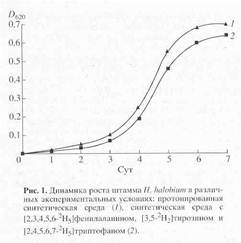
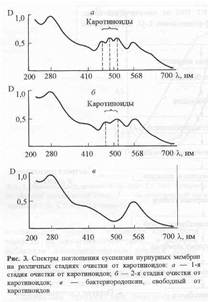
... в его функционировании [10]. Поэтому важно получать подобные модифицированные дейтерием белки в очищенном виде и в препаративных количествах. Целью настоящей работы было получение препаратов бактериородопсина, селективно меченных дейтерием по остаткам ароматических аминокислот - L-фенилаланина, L-тирозина и L-триптофана, а также масс-спектрометрический анализ дейтерий-меченных аминокислот ...
0 комментариев