Навигация
Параметры температурных циклов
1.3 Параметры температурных циклов
Полимеразная цепная реакция предусматривает инкубацию образцов при трех температурах, соответствующих трем этапам цикла амплификации, - денатурации, отжигу и достройке.
Обычно двухцепочечную ДНК денатурируют путем кратковременного нагрева образца до 90-95°С, затем проводят отжиг, охлаждая образец до 40-60°С, и далее нагревают до 70-75°С, чтобы осуществить достройку отожженных затравок с помощью 7а-7-полимеразы. Время инкубации при 70-75 СС варьируют в зависимости от длины амплифицируемой последовательности. Длительность температурного скачка определяется типом оборудования, используемого для нагрева и охлаждения. За одним лишь исключением, скорость смены температуры не имеет значения и для сокращения длительности цикла практически всегда используются быстрые температурные скачки. Однако, чтобы быть уверенным, что образцы все-таки нагрелись до необходимой температуры, время скачка следует определить, проводя замеры температуры в контрольном эксперименте амплификации. Термопара для замера в микронробах и цифровой многофункциональный счетчик очень полезны для этих целей.
Обычно длительность смены температур для 100 мкл реакционной смеси в 1,5 мл пробирках и водяных банях, настроенных на 72°, 93о и 55°С, следующая:
1) 72° — 93°С— 1 мин,
2) 93 — 55°С— 1 мин,
3) 55 — 72°С — 45 с.
Время скачка для таких же образцов, но в нагревательном блоке с формованными отверстиями обычно больше, по крайней мере, в два раза. Недостаточный прогрев на этапе денатурации — одна из наиболее распространенных причин неудач при проведении реакции ПЦР вручную. Как правило, разделение цепей происходит, если реакционная смесь нагрета выше 90°С. Чтобы гарантировать разделение, следует довести температуру смеси до 93°С. Как только этот рубеж достигнут, образец можно охлаждать до температуры отжига затравки. Долгая денатурация не является необходимой; более того, именно непродолжительное воздействие повышенных температур обеспечивает поддержание высокой активности фермента в течение всей реакции амплификации. Чтобы предотвратить потерю влаги за счет испарения с поверхности реакционной смеси, можно наслоить на нее 50 мкл минерального масла.
Температура проведения отжига зависит от длины затравки и содержания в ней GC-nap. Для типичной затравки длиной 20 нуклеотидов и 50%-ным содержанием GC-nap подбор температуры хорошо начинать с 50-60°С. Из-за большого молярного избытка затравки в реакционной смеси гибридизация происходит почти мгновенно и не требуется долгой инкубации при температуре отжига. Иногда оказывается возможным отжигать затравки и при 72°С, т.е. при температуре достройки. При этом значительно упрощается вся процедура: она сводится к двухтемпературному циклу.
В некоторых случаях, когда доступны только 12-15-нуклеотидные затравки, требуется температура отжига 40°С. Однако затравки такой длины не удерживаются на матрице при температуре достройки 72°С. Преодолеть эту трудность можно следующим образом. Используя частичную ферментативную активность полимеразы при низких температурах, можно удлинить затравки на несколько нуклеотидов и тем самым стабилизировать их. Это достигается либо за счет промежуточной инкубации в течение нескольких минут при 55-60°С или путем медленного нагревания от 40 до 72°С.
Температура достройки праймера 72°С очень близка к температуре, при которой ДНК-полимераза Taq проявляет максимальную активность. Как уже отмечено, продолжительность инкубации при 72°С зависит от длины амплифицируемого участка ДНК. Считается, что Га-полимераза синтезирует последовательность длиной 1000 нуклеотидов за 1 мин, однако можно опробовать и более короткое время инкубации. Этап удлинения затравки можно совсем исключить, если исследуемая последовательность имеет длину, не превышающую 150 нуклеотидов. При нагреве между этапами отжига и денатурации образцы будут находиться в диапазоне температур 70-75°С несколько секунд, что достаточно для полной достройки отожженной затравки.
2. Амплификация геномной последовательности «вручную»
Методика, описанная в этом разделе, предназначена для проведения амплификации однокопийной последовательности ДНК длиной до 500 п. н. Детали ее могут быть изменены в соответствии с целями эксперимента. Реакционная смесь в объеме 100 мкл включает 1 мкг геномной ДНК человека, 1-кратный солевой буфер, 1 мм каждого праймера, 0,2 мм каждого dNTP и 2,5 единиц Гад-полимеразы. В приведенном частном примере район, а также с помощью гибридизации с олигонуклеотидными пробами. Теперь для этого разработан метод секвенирования амплифицированной ДНК без предварительного ее клонирования.

Прямое секвенирование имеет два важных преимущества перед традиционным клонированием фрагментов ПЦР в плазмидных и вирусных геномах.
1. Эту процедуру проще стандартизовать, так как ее проводят in vitro и она не зависит от живых систем. 2. Метод более быстр и надежен, поскольку в норме достаточно проанализировать единственную последовательность для каждого образца. Если же мы имеем дело с клонированными ПЦР-последовательностями, то для одного образца их нужно проанализировать несколько, чтобы отличить мутации, происшедшие в исходной геномной последовательности, от случайных ошибок при достройке ДНК-полимеразой в реакции ПЦР.и таких артефактов полимеразной реакции, как образование мозаичных аллелей вследствие рекомбинации in vitro.
Простота, с которой можно получить четкие надежные данные, не прибегая к клонированию в бактериях, определяется 1) способностью ПЦР-затравок амплифицировать только интересующие последовательности и 2) способом получения образца, приемлемого для секвениро-вания. Для прямого секвенирования продуктов ПЦР вполне пригоден химический метод. Мы рассмотрим здесь только наиболее распространенный метод Сэнгера, использующий нуклеотиды-терминаторы полимеразной реакции. Специфичность ПЦР-затравок в принципе определяет гомогенность амплифицируемых последовательностей. В идеале, в результате реакции экспоненциально наращивается только интересующая последовательность. Однако в реальных условиях многие праймеры амплифицируют также различные посторонние последовательности. Повышая температуру отжига в полимеразной реакции, это осложнение удается преодолеть. К тому же для устранения затруднений, связанных со свойствами конкретной амплифицируемой последовательности, можно применить предварительную очистку интересующей последовательности электрофорезом в геле или использовать денатурирующий градиентный гель.
В конечном счете, если эти осложнения никак более не удается преодолеть, можно при секвенировании использовать внутренние праймеры, отжигающиеся только на интересующей последовательности.
Еще одно неудобство, вызванное прямым секвенированием продуктов ПЦР, обусловлено способностью двух цепей амплифицированного фрагмента к быстрой реассоциации, что мешает отжигу секвенационного праймера на комплементарной последовательности или блокирует реакцию достройки комплекса затравка — матрица. Устранить это препятствие можно, применяя один из вариантов стандартного метода секвенирования двухцепочечной ДНК или модифицируя ПЦР с целью получения одноцепочечных продуктов.
3.1 Секвестрование двухцепочечных образцов
Для приготовления двухцепочечных образцов, используемых при секвенировании, выберите одну из двух методик.
1. Денатурируйте образец NaOH, перенесите в лед, нейтрализуйте реакцию, после чего быстро осадите ДНК- Растворите ДНК в буфере, содержащем секвенационный праймер, при необходимой температуре отжига.
2. Денатурируйте образец нагреванием, затем быстро перенесите в спиртовую баню, охлажденную до температуры сухого льда, замедлив таким образом процесс реассоциации цепей. Добавьте секвенационный праймер и нагрейте до необходимой температуры отжига.
Для секвенирования двухцепочечных плазмидных ДНК подходят оба способа. Секвенировать продукты ПЦР по этим инструкциям гораздо труднее, так как короткие линейные фрагменты ДНК более склонны к реассоциации, чем двухцепочечные кольцевые плазмиды.
3.2 Секвенирование одноцепочечных фрагментов ДНК
Затруднения, связанные с реассоциацией цепей фрагмента, можно преодолеть, если приготовить одноцепочечные образцы ДНК путем разделения цепей в геле или синтезировать их в самой реакции ПЦР. Для разделения цепей фрагментов длиной не менее 500 п. н. могут быть с успехом использованы соответствующие агарозные гели. В случае более коротких фрагментов такой подход не эффективен. Однако недавно мы разработали метод, позволяющий синтезировать одноцепочечные ДНК в ходе реакции ПЦР.
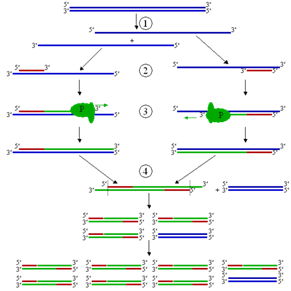
Эта процедура предусматривает использование неэквивалентных количеств двух праймеров для амплификации, что позволяет синтезировать за первые 20-25 циклов двухцепочечную ДНК и за последующие 5-10 циклов в условиях недостатка одного из праймеров — одноцепочечную ДНК.
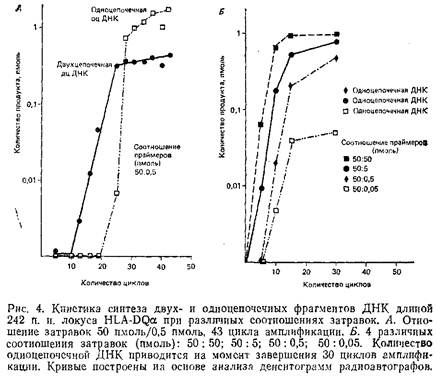
Рис. 4, А демонстрирует накопление дцДНК и оцДНК в ходе обычной амплификации геномной последовательности, использующей исходное соотношение затравок 50:0,5 пмоль в 100 мкл реакционной смеси. Как и ожидалось, количество дцДНК возрастает экспоненциально до момента практического исчезновения из реакционной смеси одного из праймеров, после чего количество этой ДНК нарастает очень медленно. Фракция оцДНК появляется, начиная с 25-го цикла, с момента, когда запас лимитирующей затравки почти полностью исчерпан. После короткой начальной стадии быстрого роста оцДНК накапливается линейно, чего следует ожидать в присутствии одного праймера.
Разные соотношения праймеров дадут в принципе сходную картину образования оцДНК. Различные неравные отношения 50:5, 50:0,5, 50:0,05 дают за 30 циклов полимеразной реакции количество оцДНК, превышающее количество синтезированной дцДНК. Как правило, соотношение 50:0,5 позволяет получить после 30 циклов ПЦР 1-5 пмоль оцДНК. Образованная оцДНК может быть затем секвенирована с использованием лимитирующего праймера ПЦР или внутреннего праймера по обычной схеме химической или энзиматической методики секвенирования. Синтезированные фрагменты будут иметь гомогенный 5'-конец и в различной степени усеченный 3'-конец вследствие преждевременной терминами синтеза. Однако при использовании некоторых секвенационных затравок только полная оцДНК. может служить образцом для секвенирования.

1. Проведите реакцию ПЦР по уже описанной методике, изменив только количества используемых праймеров на 50 пмоль и 0,5 пмоль в 100 мкл реакционной смеси. Проведите 30— 35 циклов реакции. Если необходимо секвенировать обе цепи, приготовьте также образец с обратным соотношением объема используемых затравок.
2. После завершения ПЦР смешайте 100 мкл реакционной смеси с 2 мл дистиллированной воды, заполните этой смесью микроконцентратор Centricon 30 и для удаления избытка dNTP и компонентов буфера отцентрнфугируйте при 5000 об/мин в роторе с фиксированным наклоном пробирок.
3. Высушите 10 из 40 мкл концентрата и растворите в 10 мкл секвенационного буфера, содержащего 1 пмоль секвенационного праймера.
4. Прогрейте смесь праймер — матрица при 65 °С в течение 2 мин, затем оставьте охлаждаться до 30 °С в течение 20 мин.
5. Добавьте 1 мкл 100 мМ DDT, 2 мкл смеси для включения метки, разведенной в соотношении 1/100, 0,5 мкл dATP, 10 мкКи/мкл, 2 мкл ДНК-полимеразы Т7.
6. Внесите 3,5 мкл приготовленной смеси в каждую из 4 пробирок, содержащих 2,5 мкл смеси дидезоксирибонуклеозидов, и инкубируйте 5 мин при 37°С.
Остановите реакцию добавлением 4 мкл 95%-ного формамида, 20 мм ЭДТА; прогрейте в течение 2 мин при 75°С и нанесите на секвенационный гель.
Заключение
ПЦР открывает возможность быстрого синтеза миллионов копий индивидуальной последовательности ДНК, что значительно упрощает последующий ее анализ.
Поскольку в результате цепной амплификации образуются идентичные фрагменты специфичной ДНК, сразу же может быть осуществлено клонирование или секвенирование продуктов реакции. Матрицей для ПЦР-амплификации могут служить как геномная ДНК, так и кДНК, синтезированная путем обратной транскрипции РНК- Чувствительность метода позволяет обнаружить и амплифицировать единственную молекулу ДНК- При автоматизации ПЦР и наличии нерадиоактивных материалов для мечения ДНК полнмеразная цепная реакция обещает стать в будущем стандартной молекулярно-биологической процедурой. Можно предположить, что велика будет и ее роль в диагностике наследственных и инфекционных заболеваний.
Похожие работы
... , диализу от денатурирующих добавок, изменению рН и ионной силы среды. Подлинность наработанного белка проверяют по ферментативной активности, если он должен таковой обладать. Или же по электрофорезу — сравнением с контрольным препаратом. Но надежнее — одним из иммунологических методов контроля, с которыми мы познакомимся в свое время. 2. Электрофорез Метод электрофореза таит в себе массу « ...
... использования; - лаборант во время выделения должен быть одет в специальный халат, шапочку и очки. Все манипуляции с исследуемым материалом проводят при соблюдении правил работы с вирусами III и IV группы. Постановку ПЦР осуществляют как минимум в 3 рабочих зонах: Зона 1 (ламинарный бокс, бокс с УФ-лампой): подготовка ПЦР-реагентов. Зона 2 (ламинарный бокс, бокс с УФ-лампой): подготовка проб ...
... , вызванные динамическими му-тациями.-----------------------T-----------T-------T-----T------T------T----------------------¬ Болезнь, номер по ¦ Ген, лока-¦Триплет¦Норма¦Прему-¦Мута- ¦Литература ¦ МакКьюсику (MIM) ¦ лизация ¦ ¦ ¦тация ¦ция ¦ ¦ -----------------------+-----------+-------+-----+------+------+----------------------+ Синдром ломкой X-хро- ¦FMR1, FRAXA¦(CGG)n ...
... часто приходится сталкиваться при латентных и хронических инфекциях, поскольку этот метод позволяет избежать сложностей, связанных с выращиванием таких микроорганизмов в лабораторных условиях. Применение ПЦР-диагностики также очень эффективно в отношении возбудителей с высокой антигенной изменчивостью и внутриклеточных паразитов. Следует отметить, что методом ПЦР возможно выявление возбудителей ...
0 комментариев