Навигация
Электрофорез белков (общие положения)
2.2 Электрофорез белков (общие положения)
Теперь предположим, что с помощью пипетки с отогнутым концом мы ввели в начало трубочки, заполненной Трис-НСl буфером смесь различных молекул белка. Мы знаем, что каждая молекула белка может быть положительно или отрицательно заряжена. Этот заряд определяется как сумма электрических зарядов боковых групп аминокислот: основных (лизин, аргинин, гистидин) и кислых (аспарагиновая и глутаминовая кислоты), лежащих на поверхности белка. Боковые группы, спрятанные внутри белковой глобулы, своего вклада в суммарный заряд белка не дают, так как не соприкасаются с водой и потому не ионизированы.
Начнем рассмотрение с наиболее распространенных кислых белков, т. е. таких, чьи суммарные заряды отрицательны, хотя степень их кислотности, наверное, будет разной — она зависит от соотношения числа заряженных групп разных знаков на поверхности.
Под действием того же самого электрического поля такие белки, подобно иону Сl- будут мигрировать в сторону анода. Они тоже будут испытывать сопротивление своему движению и наверняка большее, чем ион С1- в силу своих размеров и необходимости раздвигать лежащие на их пути молекулы воды.
Когда электрические силы, влекущие молекулы белков к аноду, станут равными силам сопротивления (последние тем больше, чем быстрее движение), скорости миграции белков тоже станут постоянными и, скорее всего, разными у различных белков. Эти скорости будут пропорциональны величинам суммарных зарядов каждого из белков и, разумеется, напряженности общего для них всех электрического поля. Напряженность поля зависит от электропроводности буфера, т. е. концентрации основных носителей тока (в нашем примере — ионов С1-). Присутствие белков, несмотря на их заряды, существенного влияния на электропроводность раствора иметь не должно ввиду малости их количества. Зато величины зарядов белков (а значит и скорости их миграции) будут весьма существенно зависеть не только от их природы, но и от величины рН раствора, создаваемого буфером. Собственно говоря, именно ради того, чтобы иметь возможность управлять зарядами белков, мы заменили в нашем растворе соль на буфер. Создаваемое им рН надо выбрать не так, чтобы все белки получили максимально возможный отрицательный заряд (например, в сильно щелочном буфере). Это невыгодно. Все белки будут двигаться с максимальными скоростями, не сильно отличающимися друг от друга. Выгодно выбрать умеренно щелочную среду и сыграть, таким образом, на различии соотношений основных и кислых боковых групп аминокислот на поверхности разных белков. Иными словами, добиваться максимального различия сил, действующих на разные белки — тогда на своем пути вдоль трубки они разойдутся наиболее явным образом. (Обычно для кислых белков выбирают величину рН8-8,5, а для щелочных, — гистонов, белков рибосом, — используют буферы с рН4—5. Эти последние белки будут мигрировать к катоду.)
О том, как мы будем обнаруживать и трактовать расхождение белков в геле речь впереди. А пока продолжим разговор о выборе буфера. Выше шла речь о выборе его рН. А как выбрать концентрацию буфера? Чем она выше, тем больше, как говорят, «емкость» буфера — его способность удерживать рН раствора от резких изменений при внесении в него кислот и щелочей. Но ведь мы, как будто, не собираемся их вносить? Оказывается вносим! С самими белками.
Вернемся теперь к белкам в электрофорезе. Мы их вносили в трубочку, очевидно, уже растворенными в выбранном для них буфере. Раствор этот был более или менее разбавленным. В ходе электрофореза белки, как мы увидим ниже, будут собираться в узкие зоны, где концентрация каждого из них окажется гораздо выше чем изначально. Вот там-то емкости буфера может не хватить, рН раствора может измениться. За ним изменится и суммарный заряд белка, а следовательно и скорость миграции белковой зоны. Устранить эту опасность, на первый взгляд, легко. Достаточно в несколько раз увеличить концентрацию буфера. Но это будет означать, к примеру для Трис-НСl буфера, такое же увеличение концентрации ионов С1-. А значит и увеличение силы тока и, как следствие, усиление разогрева жидкости в трубочке. В результате чего возникнут искажения картины разделения белков. Хотя бы потому, что температура жидкости в центре трубочки будет выше, чем у ее стенок. Но ведь можно уменьшить напряжение на клеммах источника. Но это приведет к падению напряженности поля и соответствующему замедлению миграции белков. Что нежелательно ввиду диффузного размытия областей (полос) миграции. В порядке компромисса выбирают обычно молярность буфера в пределах 0,1-0,2М.
Нежелательная ситуация может легко возникнуть и в том случае, когда рН рабочего буфера выбрана близ границы буферной области (см. гл. 2, § 1). Здесь буферная емкость мала по определению. И потому вышеописанный эффект изменения рН в зоне концентрации белка может быть особенно опасен.
Вполне возможно, что столкнувшись с такими трудностями экспериментатору придется отказаться от первоначально выбранного буфера и заменить его на другой, с менее подвижными ионами.
Я не собираюсь приводить здесь практические рецепты. Мне только хотелось показать, что выбор буфера для электрофореза дело тонкое, требующее вдумчивой оценки данной конкретной ситуации.
Теперь обратимся к другой стороне проблемы. До сих пор мы рассматривали только равновесие электрических сил, действующих на белки и сил трения в жидкости. Размер частиц в этом случае может сказываться двояко. С одной стороны будет увеличиваться сила трения в водной среде, но, с другой стороны, может увеличиться и суммарный электрический заряд на поверхности белковой глобулы. Попробуем различие размеров разных белков использовать более определенным образом. Для этого создадим помимо трения о жидкость еще и дополнительное трение — напрямую связанное с размерами мигрирующих молекул белка. Создадим искусственные преграды для миграции в виде пространственной сетки, ячейки которой будут соизмеримы с размерами белков. Эта сетка должна быть образована волокнами, которые надежно смачивает вода, коль скоро мы будем работать в водных растворах. В этом случае буфер будет заполнять ячейки сетки целиком. Хорошо бы, чтобы в нашем распоряжении была возможность выбирать размеры ячеек или пор этой сетки — в зависимости от диапазона размеров белков, которые мы собираемся разделять. Очевидно, что все молекулы белков должны иметь возможность проходить через поры, ни в коем случае не застревать в них. Но проходя, они должны постоянно сталкиваться с образующими поры нитями, что будет тормозить их миграцию в электрическом поле. И чем крупнее белки, тем чаще им придется испытывать эти столкновения, тем «труднее« и медленнее они будут мигрировать. Самые мелкие белки, напротив, будут проходить через поры едва касаясь их нитей. Скорость миграции для белков различной величины, опять-таки, установится постоянной, поскольку статистически постоянным будет эффект столкновения с нитями — он зависит только от соотношения размеров молекул белка и пор. Мы получаем мощное средство разделения белков по их размерам.
Таким образом, выбирая пористость сетки и оценивая результаты разделения белков придется принимать во внимание не только их массу, но и конфигурацию. Мало того, придется учитывать и жесткость (плотность упаковки) белковой молекулы. Рыхлые глобулярные (и особенно фибриллярные) белки могут деформироваться при взаимодействии с сеткой и тем самым облегчать себе миграцию между ее нитями.
Но что же это за сетка, которую мы хотим создать? И как это сделать? Скорее всего это будет гель, подобный пищевому желе, которое получают очень небольшой добавкой желатина к фруктовому соку, или нечто похожее на уже знакомый нам агар. Прежде, чем поговорить об этом геле подробнее, отметим, что благодаря силам смачивания жидкость из геля с достаточно мелкими порами не будет вытекать, даже если она составит 95% его массы. А это значит, что заполнив нашу трубочку гелем, мы можем поставить ее вертикально, как это показано на рис. 36. Кстати сказать, так и выглядели первые приборчики для электрофореза.
Рис. 36
Вертикальное расположение трубочки с гелем сразу обнаруживает одно существенное преимущество. Теперь препарат исходной смеси белков можно наносить тонким ровным слоем на верхнюю поверхность геля. В результате чего и разделяющиеся в ходе миграции в электрическом поле белки будут двигаться вниз в виде тонких дисков. (Каждый со своей скоростью, постепенно располагаясь на всей длине трубочки.)
Разумеется, буферы верхнего и нижнего резервуаров должны смачивать оба торца геля в трубочке. Поэтому гель не должен заполнять трубочку до самого верху, оставляя место для нанесения препарата. В исходную белковую смесь (тоже растворенную в буфере) можно добавить 5-10% сахарозы или глицерина. В таком виде ее можно вносить в трубочку пипеткой с оттянутым полиэтиленовым наконечником, осторожно подслаивая под буфер, находящийся в трубочке.
В ходе электрофореза зоны растворенных белков остаются невидимыми. Для наблюдения за процессом разделения в исходный препарат добавляют 0,01% красителя, молекулы которого несут на себе электрический заряд того же знака, что и фракционируемые белки, но не взаимодействуют с ними. Краситель в электрическом поле перемещается вдоль трубочки в виде окрашенной полоски. Его подбирают таким образом, чтобы скорость его миграции была немного больше, чем скорость наиболее подвижных молекул белка. Когда окрашенная полоска доходит до конца трубочки электрофорез прекращают. В качестве отрицательно заряженного красителя широко используют «Бромфеноловый синий». Для электрофореза щелочных, положительно заряженных белков — «Метиловый зеленый» или «Пиронин».
После окончания электрофореза столбик геля извлекают из трубочки, фиксируют в конечном положении миграции и белки окрашивают — прямо в геле. К методам такой фиксации и окраски мы еще вернемся, а сейчас надо будет познакомиться с природой самого геля, используемого для фракционирования белков.
Литература
1 Курашвили Л.В., Ковалев К.В. Атерогенные липопротеиды у больных с абдоминальной патологией. Научно-практичеекая конференция, посвященная 140-летию областной больницы им.Н.Н. Бурденко и в честь 110-летия со дня рождения академика Н.Н. Бурденко. Тез.докладов. - Пенза. 1986. - С.101-102.
2 Курашвили Л.В. , Устинова Т.И. Лабораторные тесты в диагностике гипоксических соотояний. Научные чтения в часть памяти академика Н.Н. Бурденко). - Пенза, 1988. С.148-150.
3 Курашвили Л.В., Волков А.С., Прокаева П.А. Коэффициент атерогевности и холестерин в диагностике нарушений липидного обмена. VI Научные чтения памяти академика Н.Н. Бурденко. - Пенза, 1988. - С.165-166.
4 Курашвили Л.В., Савченко Р.П. Метаболизм липидов у больных в терминальной стадии хронической почечной недостаточности // Казанский медицинский журнал. - 1990. - Т.XXI. - N 5. - С.338-340.
Похожие работы
... . Тем не менее, при условии решения проблемы конкуренции за праймеры, этот способ контроля эффективности амплификации безусловно будет весьма полезен. 4. Методы, основанные на полимеразной цепной реакции 4.1 Качественный анализ Классический способ постановки ПЦР, принципы которого были изложены выше, нашел свое развитие в некоторых модификациях, направленных на преодоление ограничений ...
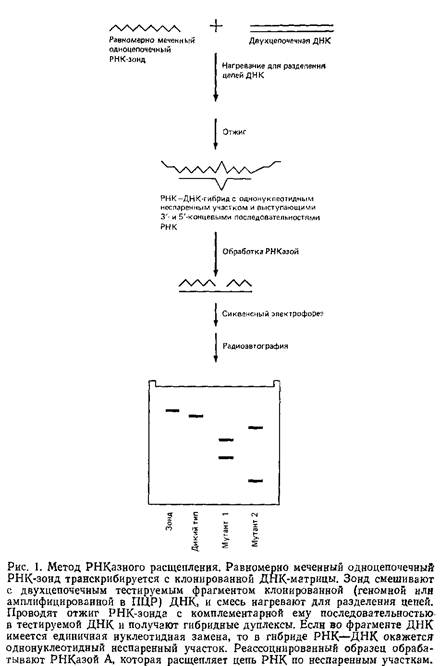
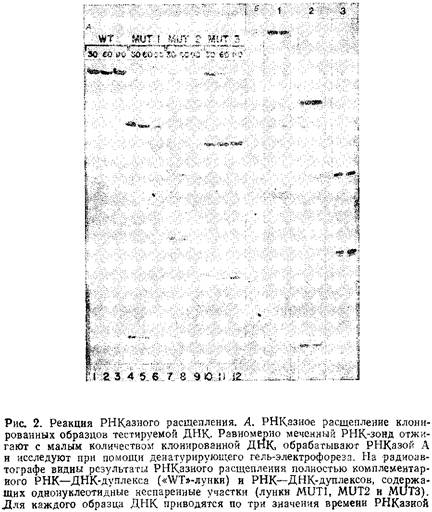
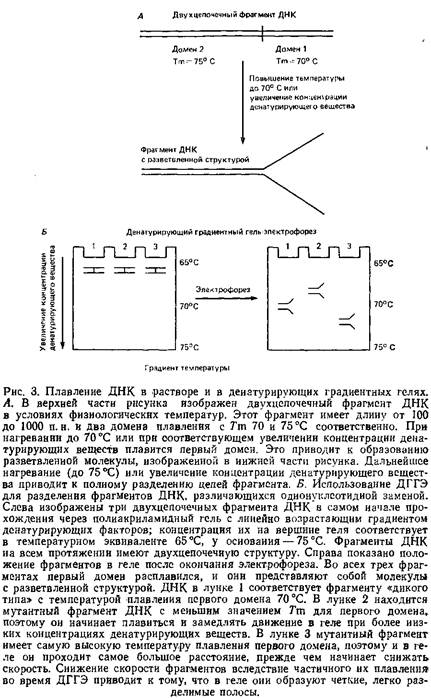
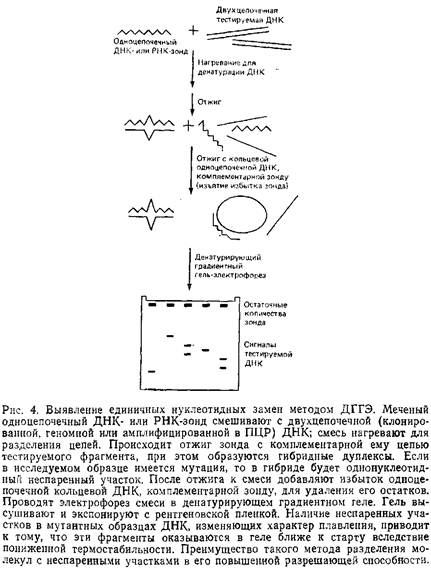
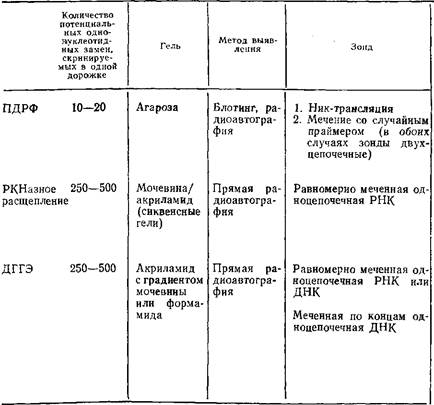
... геле. Поэтому приведенные ниже методики для исследования образцов ДНК с равным успехом могут использоваться и при работе с РНК. 1.2 Денатурирующий градиентный гель-электрофорез Два фрагмента ДНК, различающиеся лишь делецией, инсерцией или заменой одного нуклеотида, или единственным неспаренным нуклеотидом, можно легко разделить при помощи денатурирующего градиентного гель-электрофореза, ДГГЭ ...
... использования; - лаборант во время выделения должен быть одет в специальный халат, шапочку и очки. Все манипуляции с исследуемым материалом проводят при соблюдении правил работы с вирусами III и IV группы. Постановку ПЦР осуществляют как минимум в 3 рабочих зонах: Зона 1 (ламинарный бокс, бокс с УФ-лампой): подготовка ПЦР-реагентов. Зона 2 (ламинарный бокс, бокс с УФ-лампой): подготовка проб ...
... , вызванные динамическими му-тациями.-----------------------T-----------T-------T-----T------T------T----------------------¬ Болезнь, номер по ¦ Ген, лока-¦Триплет¦Норма¦Прему-¦Мута- ¦Литература ¦ МакКьюсику (MIM) ¦ лизация ¦ ¦ ¦тация ¦ция ¦ ¦ -----------------------+-----------+-------+-----+------+------+----------------------+ Синдром ломкой X-хро- ¦FMR1, FRAXA¦(CGG)n ...
0 комментариев