Навигация
1.3 Фосфодиэстераза
В прекращении сигнала цАМФ участвуют фосфодиэстераза, гидролизующая этот нуклеотид до АМФ. В противоположность аденилатциклазе фосфодиэстераза – преимущественно растворимый фермент. В то же время активность фермента обнаружена во фракциях саркоплазматического ретикулума, митохондрий и ядер.
Циклонуклеотидактивируемая фосфодиэстераза гидролизует как цАМФ, так и цГМФ, при этом под действием цГМФ ускоряется гидролиз цАМФ и наоборот, что свидетельствует о положительной кооперативности двух активных центров. Несомненна роль фермента в проведении нервного импульса: так, в постсинаптической мембране нервной ткани обнаружен необычайно высокий уровень фосфодиэстеразы цГМФ.
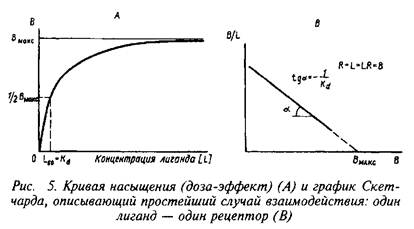
Для фосфодиэстеразы характерно наличие множественных форм. Эти формы различаются как по молекулярной массе, так и по сродству к одному и тому же и к различным циклическим нуклеотидам. В целом, сродство к циклическим нуклеотидам у фосфодиэстераз в 100–1000 раз ниже, чем у протеинкиназ А и G, поэтому при ускорении синтеза нуклеотидов сначала происходит насыщение циклическими нуклеотидами регуляторных центров киназ и лишь затем – гидролиз цАМФ и цГМФ фосфодиэстеразами.
В мозге содержатся Са-кальмодулинрегулируемые формы как цАМФ-синтезирующего, так и цАМФ-гидролизующего ферментов. Са-кальмодулинзависимая фосфодиэстераза представляет собой гомодимер, состоящий из субъединиц с различной молекулярной массой у разных изоформ фермента. Ограниченный протеолиз субъединицы 60 кД приводит к появлению фрагмента с Мг = 36 кД и необратимой активации фосфодиэстеразы. Фрагмент 36 кД более не активируется кальмодулином. Следовательно, субъединицы фосфодиэстеразы включают 2 фрагмента: каталитический и регуляторный.
Анализ регуляторных свойств фосфодиэстеразы в нервной ткани свидетельствует о тесном сопряжении между цАМФ- и Са-зависимыми системами внутриклеточной сигнализации; это сопряжение может модулироваться с помощью изоферментов фосфодиэстеразы. Так, в мозге быка найдены 2 изоформы Са-КМ-зависимой фосфодиэстеразы, состоящей из субъединиц с Мг = 60 и 63 кД. Изофермент с субъединицами 60 кД может быть фосфорилирован цАМФ-зависимой протеинкиназой, что приводит к уменьшению сродства фосфодиэстеразы к кальмодулину. Дефосфорилирование этого изофермента осуществляет Са-КМ-стимулируемая протеинфосфатаза; при этом восстанавливается чувствительность фосфодиэстеразы к кальмодулину.
В отличие от изофермента с субъединицами 60 кД фосфорилирование изоформы фосфодиэстеразы с субъединицами 63 кД осуществляется Са-КМ-зависимыми протеинкиназами. Это фосфорилирование также приводит к потере чувствительности фосфодиэстеразы к кальмодулину и "обращается" Са-КМ-стимулируемой протеинфосфатазой с восстановлением чувствительности фосфодиэстеразы к КМ. Очевидно, такой механизм регуляции фосфодиэстеразы реализуется в мозге in vivo, несмотря на очень высокую, "насыщающую" концентрацию в нем КМ. Фосфорирование снижает сродство фермента к КМ и обусловливает зависимость его активности от физиологических концентраций Са+.
В нервной ткани, таким образом, существует тесная взаимосвязь между двумя системами вторичных посредников, Са+ и цАМФ, осуществляемая посредством цАМФ- и Са-зависимого фосфорилирования-дефосфорилирования различных изоферментов фосфодиэстеразы цАМФ. Эта взаимосвязь может модулироваться также различным сродством к Са+ аденилатциклазы, фосфодиэстеразы, протеинкиназы и фосфатазы. Так, аденилатциклаза мозга активируется гораздо более низкими концентрациями Са чем фосфодиэстераза.
Кроме циклических нуклеотидов, Са+ и ограниченного протеолиза фосфодиэстеразу активируют также полианионы, фосфолипиды, жирные кислоты. Ингибиторами или активаторами фермента являются многочисленные фармакологические вещества. Фосфодиэстераза является более "удобной" мишенью для действия лекарственных препаратов, чем аденилатциклаза, так как менее специфична в отношении эффекторных влияний. Мощными ингибиторами фосфодиэстеразы являются производные ксантинов – ингибирование осуществляется блокадой аллостерического центра связывание нуклеотидов.
2. цГМФ-зависимое протеинфосфорилирование
Вскоре после открытия цАМФ-зависимых протенкиназ был обнаружен еще один класс циклонуклеотидзависимых фосфорилирующих ферментов, стимулируемых с помощью цГМФ, – протеинкиназы G. В тканях млекопитающих содержание протеинкиназ G весьма невелико. Наиболее высок уровень активности и содержания протеинкиназ G в мозжечке, сердечной мышце и легких, эти же ткани содержат и наибольшее количество цГМФ, не превышающее, впрочем, 10% от содержания в них цАМФ. Основное количество протеинкиназы G обнаружено в цитозоле, некоторая часть фермента связана с цитоплазматическими мембранами и ядерной фракцией.
Фермент состоит из двух примерно идентичных субъединиц, каждая из которых имеет каталитическую активность и способна связывать циклический нуклеотид. Ограниченным протеолизом можно перевести димер в мономеры и затем разделить каждую субъединицу на цГМФ-связывающий и каталитический фрагменты. Эти исследования наряду с выявленной гомологией между протеинкиназой G и протеинкиназой А II типа по субстратной специфичности, аминокислотной последовательности, способности к аутофосфорилированию, иммунологическим свойствам привели к представлению о том, что цАМФ и цГМФ-зависимые протеинкиназы эволюционировали от общего гена, кодирующего одну полипептидную цепь. В процессе развития цАМФ-зависимый фермент стал синтезироваться в виде разобщенных компонентов, тогда как цГМФ-зависимая протеинкиназа синтезируется как одна цепь.
В отличие от каталитической субъединицы протеинкиназы А, способной высвобождаться во время активации фермента, внутриклеточное перемещение "недиссоциированной" протеинкиназы G может быть затруднен. На основании аминокислотного анализа протеинкиназы G было установлено, что одна субъединица фермента содержит два центра связывания нуклеотида.
Регуляторная N-концевая половина молекулы протеинкиназы G сходна с семейством цАМФ-связывающих белков, в то время как каталитическая Сконцевая половина родственна группе киназ с различной специфичностью. Протеинкиназа G способна к аутофосфорилированию из расчета 2 моля фосфата на 1 моль холофермента. Аутофосфорилирование не изменяет сродства к цГМФ и незначительно повышает Vmakc фосфотрансферазной реакции, но заметно увеличивает сродство протеинкиназы G к цАМФ. Таким образом, аутофосфорилирование может обусловливать регуляцию протеинкиназы G не только с помощью цГМФ, но и цАМФ.
Протеинкиназа G фосфорилирует, вероятно, те же аминокислотные остатки в молекуле субстрата, что и протеинкиназа А, но с гораздо меньшей скоростью. Различная скорость фосфорилирования протеинкиназ А и G может являться основой их субстратной специфичности.
Как упоминалось, наибольшее содержание протеинкиназы G в нервной ткани отмечено в мозжечке. В свою очередь, в этом отделе мозга фермент локализован в клетках Пуркинье. Найдена корреляция между увеличением содержания G-киназ в цитоплазме клеток Пуркинье, началом роста дендритов и установлением синаптических контактов в клетках Пуркинье и подобных им субкортикальных клетках, что может свидетельствовать в пользу безусловной значимости цГМФ-зависимого фосфорилирования для нейрональной дифференцировки этих клеток. В клетках Пуркинье находится и единственный в мозге млекопитающих специфичный субстрат для протеинкиназы G, названный G-субстратом; G-субстрат – кислоторастворимый и термостабильный белок с Мг = 23 кД. Обнаружено, что фосфорилированный с помощью цГМФ-зависимой протеинкиназы G-субстрат ингибирует протеинфосфатазу, выделенную из мозжечка, являясь специфичным для клеток Пуркинье протеинфосфатазным ингибитором. При этом ингибируемая фосфатаза из этих клеток, вероятно, катализирует дефосфорилирование белков, не являющихся субстратами протеинкиназы А.
Увеличение уровня цГМФ обусловлено взаимодействием с плазмалеммой различных гормонов и нейромедиаторов. Так активируется связанная с мускариновыми рецепторами гуанилатциклаза Активация гуанилатциклазы обычно обусловлена мобилизацией Са+ из эндоплазматического ретикулума.
В клетках мозга обнаружен термостабильный белок, стимулирующий активность протеинкиназы G, но не изменяющий активность протеинкиназы А. Обратный процесс – инактивация протеинкиназы G состоит в гидролизе цГМФ фосфодиэстеразой, специфичной для этого нуклеотида. Кроме того, в тканях млекопитающих, в том числе и нервной, найден ингибитор G-киназы с Мг = 15 кД.
Отметим, что системы циклических нуклеотидов осуществляют внутриклеточную регуляцию в тесном взаимодействии друг с другом. Так, например, если концентрация цАМФ в клетке длительное время повышена, может происходить фосфорилирование белков, встроенных в каналы плазматической мембраны, что приводит к повышению в цитоплазме концентрации Са+. В результате этого активируются фосфодиэстераза и гуанилатциклаза; соответственно ускоряется гидролиз цАМФ и образуется цГМФ.
Итак, цГМФ играет важную роль в нервной системе, особенно в клетках Пуркинье мозжечка. Об этом свидетельствует избирательная локализация в этих клетках всех компонентов системы цГМФ, включая гуанилатциклазу, протеинкиназу G и G-субстрат. Различные нейромедиаторы, в том числе ацетилхолин, вызывают увеличение уровня цГМФ в клетках Пуркинье и активацию G-киназы, что, по всей видимости, модулирует такие свойства этих клеток, как скорость проведения возбуждения и способность к стимуляции.
Установлено также, что цГМФ модулирует активность ионных каналов мембран нервных клеток. Так, введение в нейроны улитки цГМФ или G-киназы увеличивает проводимость Са-каналов.
Похожие работы
... роль нейрорецепторов сводится к созданию специфических информационных входов, организующих единый функциональный ансамбль нейронов. Именно совокупность рецепторов определяет лицо клетки и ее реакции на поступление разнообразных химических сигналов. Молекулярные механизмы, лежащие в основе модуляции эффективности синаптической передачи, в которых важную роль играют рецепторные процессы, имеют ...
... мышление и др., а также индивидуальные особенности (способности). Таким образом, проблема научения является одной из фундаментальных в психологии вообще и психофизиологии в частности, поскольку она позволяет понять психическую адаптацию человека к условиям существования, сколь бы они ни были необычными, своеобразными, чрезвычайными. В непосредственной связи с научением находится проблема памяти. ...
... плотно смыкаются друг с другом и практически полностью обвертывают кровеносный сосуд. Подобная изоляция сосуда является одним из способов формирования гематоэнцефалического барьера - граници между кровью и нервной тканью, закрытой для многих находящихся в крови веществ. Другие отростки астроцита почти целиком обвертывают тела нейронов. Если нейрон возбуждается длительно, вокруг него повышается ...
... . И.П. Павлову, первому из русских ученых, 7 октября 1904 г. была присуждена Нобелевская премия в знак признания его работ по физиологии пищеварения. Потребность организма в пище проявляется в виде физиологической реакции голода. У человека голод приобретает выраженную субъективную окраску — от относительного безразличия к пище до яркой эмоциональной реакции. Физиологической основой голода ...
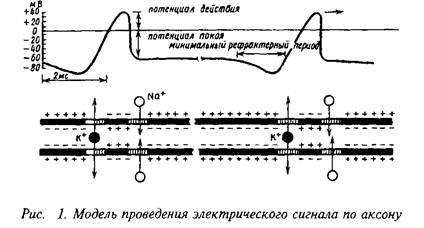
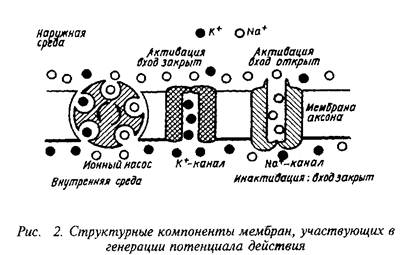
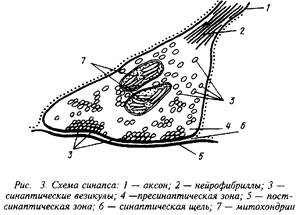
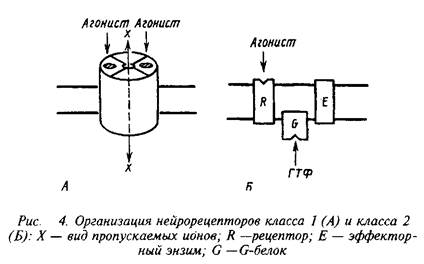
0 комментариев