Навигация
Образование диацилглицерина и инозитолфосфатов
4.1 Образование диацилглицерина и инозитолфосфатов
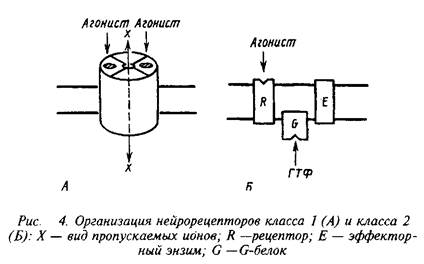
Эта группа вторичных посредников образуется при активации фосфолипазы С, локализованной в наружной клеточной мембране. Для ее активации необходимо связывание ряда гормонов и нейромедиаторов, известных своей способностью увеличивать концентрацию Са+ в цитозоле, с соответствующими рецепторами. К числу агонистов, стимулирующих фосфолипазу С, относят ацетилхолин, норадреналин, гистамин, серотонин, а также ряд гормонов белковой природы и ростовых факторов. Сопряжение фосфолипазы С с рецепторами достаточно специфично; например, из 4 известных основных типов адренорецепторов характерно только для c-типа, а из 2 типов холинорецепторов – только для мускарин-чувствительного, но не для никотинчувствительного. Так же, как и в случае аденилатциклазы, для сопряжения рецептии и активации фосфолипазы С необходимы G-белки, иногда называемые Gp. Установлено, что белок типа Gj также может непосредственно принимать участие в регуляции фосфолипазы С, а Gs – опосредовано, путем цАМФ-зависимого ингибирования фосфолипазы С.
Субстратом фосфолипазы С является фосфатидилинозитол-дифосфат – относительно редкий фосфолипид мембран.
Фермент расщепляет фосфатидилинозитолдифосфат на липидный компонент диацилглицерин, который остается в мембране, и водорастворимый инозитолтрифосфат. Если в системе цАМФ трансмембранный перенос информации происходит с образованием одного вторичного посредника, то в фосфоино-зитидной системе идет раздвоение пути передачи сигнала, так как в результате образуются два различных вторичных посредника: диацилглицерин и инозитолтрифосфат. Они действуют в клетке согласованно и активируют соответствующие пулы протеинкиназ.
Инозитолтрифосфат стимулирует высвобождение кальция из эндоплазматического ретикулума, при этом активируется семейство Са-КМ-зависимых протеинкиназ. Его концентрация, необходимая для достижения максимальной скорости высвобождения Са+ из депо ретикулума в нервной ткани, существенно ниже по сравнению с другими тканями. Таким образом, чувствительность эндоплазматического ретикулума к инозитолтрифосфату в клетках нервной системы может быть наиболее высокой.
Инозитолтрифосфат, очевидно, не единственный из инозитолтрифосфатов, выступающих в роли вторичного посредника. Образуемый в результате фосфорилирования инозитолтрифосфата инозитолтетрафосфат также участвует в регуляции внутриклеточной концентрации Са+. Эта регуляция осуществляется, вероятно, влиянием инозитолтетрафосфата на поступление внеклеточного Са+ в цитоплазму. Поступление Са" в клетку в этом случае происходит не через рецепторзависимые Са-каналы, а каким-то иным, пока неизвестным способом.
Диацилглицерин служит источником арахидоновой кислоты, активирующей гуанилатциклазу. Этот путь регуляции имеет особое значение для реализации эффектов холинергической импульсации и функции мускаринчувствительных холинорецепторов и Н1 – рецепторов гистамина, для которых роль цГМФ как вторичного посредника общепризнанна. Следовательно, в системах вторичных посредников – цГМФ и фосфоинозитидной – существует функциональная взаимосвязь через стадию образования арахидоната, обеспечивающая интегральный характер транссинаптической регуляции биохимических процессов в клетке.
Из арахидоновой кислоты образуются простаглавдины, тромбоксан и, кроме того, под действием соответствующей киназы диацилглицерин превращается в фосфатидную кислоту. Предполагается, что фосфатидная кислота обладает Са-ионофорными свойствами. Так, фосфатидная кислота накапливается в мембранах клеток при действии Са-агонистов. По такому механизму, очевидно, происходит инактивация электровозбудимых Са-каналов нейронов при действии дофамина. Взаимодействуя с собственным мембранным рецептором, дофамин в нейронах большого прудовика через G-белок активирует фосфолипазу С. Образовавшаяся из диацилглицерина фосфатидная кислота индуцирует поступление в клетку внешнего кальция и накопление его в примембранном слое цитоплазмы. Результатом локального повышения концентрации Са+ является инактивация электровозбудимьгх Са-каналов. Таким образом, система метаболизма фосфатидилинозитидов может регулировать внутриклеточную концентрацию Са+ как посредством увеличения потока Са+ через плазматическую мембрану, так и за счет выхода Са+ из внутриклеточных депо.
Наконец, диацилглицерин активирует также протеинкина-зу, связанную с плазмалеммой, – фосфолипидзависимый, Са-активируемый фермент – протеинкиназу С.
4.2 Протеинкиназа С
Уже отмечалось, что протеинкиназы, как и сопряженные с ними G-белки, имеют различную преимущественную локализацию в клетках нервной ткани. Так, аденилатциклаза и протеинкиназа С присутствуют в высоких концентрациях в мозжечке, но С-киназа локализована в клетках Пуркинье, в то время как аденилатциклаза – в гранулярных клетках. Таким образом, разные типы клеток мозга адаптированы к сигналам, активирующим синтез различных вторичные посредников: цАМФ, цГМФ, инозитолтрифосфата и дианилглицерина. В мозжечке рецепторов фосфоинозитидной системы примерно в 500 раз больше, чем в периферической нервной ткани.
Во многих отделах мозга, включая мозжечок, рецепторы фосфолипазы С и С-киназа имеют одинаковую локализацию и функционируют синергично. Однако в некоторых отделах, таких, как грудной отдел спинного мозга, рецепторы и киназа разобщены; две ветви этого внутриклеточного сигнального пути не составляют там эквивалентную пару. Поэтому в ряде случаев диацилглицерин формируется и активирует С-киназу без образования инозитолтрифосфата. В этих случаях, очевидно, диацилглицерин образуется уже не из фосфатидилинозитолдифосфата, а из монофосфорилированного мембранного липида – фосфатидилинозитола Таким образом, в нервной ткани имеется еще один вариант активации протеинкиназы С.
Протеинкиназа С обнаружена в разных тканях млекопитающих и лишена строгой тканевой и видовой специфичности. Однако в мозге ее концентрация является наибольшей. Субклеточное распределение протеинкиназы С неодинаково в разных тканях и органах: фермент преимущественно локализован в ци-тозоле клеток сердца и в мембранной фракции клеток мозга. Протеинкиназа С мозга – мономер с Мг = 80–87 кД, состоящий из двух доменов: регуляторного, имеющего участки связывания для диацилглицерина и фосфолипидов, и каталитического. Домены разделяют участок полипептидной цепи, чувствительный к протеолитической атаке.
Наибольший активирующий эффект на протеинкиназу С оказывают диацилглицерины и в меньшей мере фосфатидилянозитол, фосфатидилсерин и фосфатидная кислота. Диацилглицерины увеличивают сродство протеинкиназы С к фосфолипидам. При этом протеинкиназа С становится чувствительной к физиологическим концентрациям Са+ в клетке. Диацилглицерин быстро образуется в ответ на сигнал-рецепторное взаимодействие и быстро разрушается, что в конечном итоге и определяет его свойства как вторичного посредника.
Известно, что сродство С-киназы к плазматическим мембранам увеличивается во время активации. Для транслокации киназы необходим Са+. Связывание С-киназы с мембранами обусловлено координационным взаимодействием 4 карбоксильных групп молекул фосфатидилсерина с комплексом Са+-фермент.
Таким образом, индуцированное инозитолтрифосфатом увеличение внутриклеточной концентрации Са+ может активировать С-киназу при встраивании ее в мембраны. Активированная и локализованная на наружной мембране С-киназа обусловливает фосфорилирование белковых компонентов ионных каналов, изменяя тем самым их проницаемость.
Как недавно установлено, Са+ и фосфолипиды не всегда необходимы для активации протеинкиназы С. Так, ненасыщенные жирные кислоты могут активировать фермент независимо от Са+ и фосфолипидов. В составе изоферментов протеинкиназы С обнаружена также Са-независимая, но фосфолипидзависимая форма фермента.
Протеинкиназа С подвергается аугофосфорилированию в присутствии Са+ и фосфолипидов. Физиологическое значение этого процесса состоит, вероятно, в повышении активности киназы. Установлена также активация протеинкиназы С ограниченным протеолизом под действием мембраносвязанной Са-активируемой эндогенной протеазы. Полученные фрагменты теряют сродство к мембранам независимо от присутствия Са+ и диацилглицерина. Такие рас* творимые фрагменты С-киназы, активность которых не зависит от Са* и фосфолипидов, появляются при взаимодействии форболовых эфиров с некоторыми клетками. Ингибиторы Са-зависимых протеиназ блокируют это действие форболовых эфиров. Очевидно, при стимуляции рецепторов фосфолипазы С увеличение внутриклеточной концентрации ионизированного Са+ под действием инозитолтрифосфата приводит наряду с транслокацией С-киназы на мембраны также к активации мембраносвязанных, Са-стимулируемых протеиназ и появлению независимой от Са+ и фосфолипидов активности С-киназы.
Таким образом, фосфорилирующая способность С-киназы может быть сохранена достаточно долго после прекращения действия вторичных посредников, что наводит на мысль об участии этого процесса в долговременном хранении информации в нейронах мозга – органа с наибольшей активностью протеинкиназы С.
Сильными ингибиторами протеинкиназы С являются такие фармакологические агенты, как психотропные препараты фенотиазинового ряда и местные анестетики. Очевидно, фармакологическое действие этих препаратов, которое раньше связывали с ингибированием кальмодулина, обусловлено их липофильной природой и способностью конкурентно связываться с фосфолипидами, тем самым препятствуя активации протеинкиназы С. Полиамины также способны ингибировать протеинкина-зу С, что связано с избыточным положительным зарядом этих соединений. В мозге недавно обнаружен термостабильный ингибитор С-киназы: димер белковых субъединиц с Мг = 19 кД. Кальмодулин и другие Са-связываюшие белки также ингибируют активность фермента, вероятно, за счет влияния на механизм активации С-киназы.
В клетках мозга найдено несколько субстратов для протеинкиназы С. Отметим среди них основной белок миелина, 87 кД-белок и В-50-белок. Степень фосфорилирования основного белка миелина протеинкиназой С, присутствующей в миелине, увеличивается in vivo при К+-деполяризации мембраны. Протеинкиназы В не оказывают такого действия.
Установлено, что активация С-киназы форболовыми эфирами приводит к увеличению секреции нейромедиаторов, вызванной пресинаптическими потенциалами действия. Полагают, что способность С-киназы увеличивать секрецию связана именно с фосфорилированием упомянутого выше 87 кД-белка. Этот белок локализован преимущественно в синаптосомах – как в мембранной, так и цитозольной фракциях. Вероятно, его фосфорилирование С-киназой в окончаниях нейронов обусловливает регуляцию Са-зависимой секреции нейромедиаторов.
В-50-белок ассоциирован с пресинаптическими мембранами нейронов мозга. Как недавно установлено, этот белок проявляет активность фосфатидилинознтол-4-фосфат киназы – фермента, участвующего в синтезе фосфатидилинози-толдифосфата. Таким образом, передача сигнала через систему фосфатидилинозитола в мозге может регулироваться с помощью фосфорилирования В-50-белка протеинкиназой С.
Протеинкиназа С, по-видимому, регулирует как хемозависимые так и электрозависимые Са-каналы в нервных клетках. Так, искусственные аналоги диацилглицерина – форболовые эфиры – в задних корешках спинного мозга, блокируют хемозависимые Са-каналы в концентрациях, при которых эти соединения активируют протеинкиназу С. Установлено также, что внутриклеточная инъекция протеинкиназы С увеличивает амплитуду электрозависимого Са-тока и уменьшает Са-активируемый калиевый ток в нейронах моллюска аплизии. При этом, по имеющимся данным, С-киназа преимущественно фосфорилирует регуляторные компоненты мембран, сопряженные с каналами, а не пептиды, формирующие собственно трансмембранные каналы. Таким образом, приведенные данные о влиянии на секрецию нейромедиаторов и трансмембранные потоки ионов свидетельствуют о непосредственном участии С-киназы в важнейших процессах нервной ткани.
Оценивая место протеинкиназы в системах регуляции, отметим, что существуют два варианта взаимодействия между системами вторичных посредников, определяемые как состоянием рецепторов, так и распределением в разных тканях, природой и условиями для фосфорилирования отдельных белков-мишеней: синергизм и антагонизм. Протеинкиназа С, по всей видимости, является тем звеном, которое путем тонкой подстройки сопрягающего аппарата связывает аденилатциклазную и фосфолипазную системы передачи и усиления сигнала.
Так, обнаружено фосфорилирование протеинкиназой С а-субъединицы G{, ведущее к снятию ингибиторного действия этого сопрягающего белка на аденилатциклазу. Кроме того, уже упоминалось, что G{ может быть одним из прямых активаторов фосфолипазы С. Непрямая активация фосфолипазы С может быть обусловлена увеличением активности фосфолипазы А2 при действии Gi. Показано ингибирование фосфолипазы С посредством активации Gs. Так, установлено уменьшение образования диацилглицерина и инозитолтрифосфата при повышении уровня цАМФ с помощью гормонов, дибутирил-цАМФ, форсколина. Вероятно, угнетение активности протеинкиназы С при активации протеинкиназы А обусловлено десенситизацией соответствующих рецепторов, потерей их чувствительности к агонистам. В пользу такого заключения свидетельствуют данные о потере специфического связывания с агонистами мускариновых холинорецепторов синаптических мембран при фосфорилировании этих рецепторов К-субъединицей протеинкиназы А. В свою очередь, стимуляция М-холинорецепторов сердца вызывает уменьшение активности аденилатциклазы и снижение уровня цАМФ.
Вместе с тем известны и примеры синергизма во взаимодействии протеинкиназ. Синергизм в действия протеинкиназ А, В и С отчетливо проявляется при фосфорилировании фосфоламбаиа – белка саркоплазматического ретикулума миокарда. Показано увеличение индуцированного инозитолтрифосфатом высвобождения Са+ под действием К-субъединицы протеинкиназы А, ингибитор К-субъединииы блокирует этот эффект Установлено также, что протеинкиназа С в некоторых типах клеток потенциирует р-адренергическую стимуляцию образования цАМФ. Преинкубация эндотелиальных клеток в присутствии 10 мкм и "внутреннему" механизмам. В первом случае различные метаболиты связываются с субстратом, изменяя скорость дефосфорилирования; во втором случае лиганды связываются с фосфатазой и, таким образом, прямо изменяют фосфатазную активность.
Изучение фосфатаз привело к открытию множества форм фермента, которые дефосфорилируют широкий спектр фосфо-белков. Д. Коэн и соавторы классифицировали протеинфосфатазы на два типа. Фосфатазы 1-го типа ингибируются белковыми инибиторами, относительно нечувствительны к ингибированию АТФ и предпочтительно дефосфорилируют р-субъединицу киназы фосфорилазы. Фосфатазы 2-го типа не ингибируются термостабильными белковыми ингибиторами, чувствительны к ингибированию АТФ и преимущественно дефосфорилируют а-субъединицу киназы фосфорилазы. В свою очередь, все фосфопротеинфосфатазы 2-го типа делятся на подтипы 2А, 2В и 2С. Отличительной особенностью фосфатаз 2С является регулируемость M.g, а фосфатаз 2 В-зависимость от Са+ и кальмодулина.
Протеинфосфатазы 2 В и 2А присутствуют в мозге в наибольших концентрациях по сравнению с другими тканями. В нервной ткани найдены также специфические протеинфосфатазы, дефосфорилирующие основной белок миелина, синапсин 1, МАР-2, белки цитоскелета, никотиновые рецепторы ацетилхо-лина. Наибольшая активность фосфопротеинфосфатаз нервной ткани выявлена в мембранной фракции по сравнению с цитозолем, что свидетельствует о возможном участии этих ферментов в синаптической передаче.
Заметим, что ранее протеинфосфатаза 2В была названа кальцинейрином, так как впервые она была идентифицирована в нервной ткани как термолабильный ингибитор КМ-стимулируемой фосфодиэстеразы циклических нуклеотидов. Кальцинейрин принадлежит к семейству КМ-связывающих белков, содержащих Са-связьшающие субъединицы. Активность кальцинейрина контролируется ионами кальция.
Недавно обнаружено, что кальцинейрин, кроме серина и треонина, способен дефосфорилироеать также тирозиНовые остатки белков. Это предполагает участие кальцинейрина в процессах трансформации и клеточного роста, контролируемых, как известно, тнрозинкиназами. Интересно, что в N-конце субъединицы В кальцинейрина содержится миристиновая кислота, что может облегчать встраивание белка в мембрану.
В мозге кальцинейрин локализован в основном в постсинаптических мембранах и тесно связан с микротрубочками дендритов, что предполагает его участие в транссинаптической передаче и функционировании микротрубочек. Основными субстратами кальцинейрина в нервной ткани являются белки DARPP-32, G-субстрат и Р-субъединица II типа протеинкиназы А.
В мозге содержатся также ингибиторы протеинфосфатаз: так называемый фосфатазный ингибитор 1 и белок DARPP-32 найдены в мозге и фосфорилируются эндогенной А-киназой по единственному остатку треонина. В фосфорилированной форме DARPP-32, как и фосфатазный ингибитор 1, ингибирует активность протеинфосфатазы I. DARPP-32 сопряжен в мембранах с дофаминовыми рецепторами аденилатциклазы и, таким образом, может принимать участие в транссинаптическом действии дофамина.
Кальцинейрин и DARPP-32 локализованы вместе в синаптических мембранах. Следовательно, степень фосфорилирования DARPP-32 и медиаторное действие дофамина могут регулироваться цАМФ и Са+.
Отметим, что кальцинейрин может выступать в роли своеобразного антагониста биохимических эффектов цАМФ, модулируя тем самым взаимодействие двух систем вторичных посредников – цАМФ и Са+, Так, кальцинейрин дефосфорилирует многие субстраты протеинкиназы А, в том числе аутофосфорилированную форму регуляторной субъединицы протеинкиназы АII типа. В последнем случае кальцинейрин может прямо контролировать цАМФ-зависимую протеинкиназную активность, так как степень фосфорилирования Р-субъединицы II типа определяет характер диссоциации холофермента протеинкиназы и. соответственно, скорость фосфорилирования.
цГМФ регулирует активность протеинфосфатаз 1 и 2А в клетках Пуркинье мозжечка с помощью фосфорилирования G-субстрата протеинкиназой G. G-субстрат, как упоминалось, является специфическим протеинфосфатазным ингибитором. Дефосфорилирование этого ингибитора кальцинейрином может, таким образом, сопрягать влияние цГМФ и Са+ на функциональную активность клеток Пуркинье.
В синаптических мембранах обнаружены также две эндогенные, тесно связанные с этими мембранами специфические протеинфосфатазы. Эти протеинфосфатазы дефосфорилируют белки синаптических мембран: синапсин 1 и Р-субъединицу II типа протеинкиназы А. При этом фосфатаза, имеющая высокое сродство к Р-субъединице, не дефосфорилирует синапсин 1, а фосфатаза синапсина 1 – Р-субъединицу. Кроме того, специфичная протеинфосфатаза Р-субъединицы стимулируется цАМФ, в то время как протеинфосфатаза синапсина 1 нечувствительна к этому нуклеотиду. Таким образом, цАМФ может стимулировать как аутофосфорилирование, так и дефосфорилирование Р-субъединицы А-киназы II типа.
Для понимания многообразия и важности функций систем фосфорилирования – дефосфорилирования важны недавние сообщения о выделении эндогенной Са-независимой протеиназы, тесно ассоциированной с нейрофиламентами и другими компонентами цитоскелета. Эта протеиназа "атакует" только нефосфорилированные нейрофиламенты, расщепляя их на лишенные биологической активности фрагменты. Следовательно, фосфорилирование защищает белки цитоскелета от деградации, обусловленной действием эндогенных, Са-независимьгх протеиназ.
Напротив, Са-активируемые нейтральные протеиназы с помощью ограниченного протеолиза расщепляют фосфорилированную форму нейрофиламентов на биологически активные фрагменты. Установлено, что фосфорилирование белков цитоскелета, в частности нейрофиламентов, – необходимое условие для их сборки в организованные, морфологически единые структуры.
Таким образом, состояние цитоскелета нервных клеток определяется как цАМФ-зависимым фосфорилированием его компонентов, так и Са-зависимым дефосфорилированием: степень фосфорилирования белков цитоскелета, в свою очередь, может регулировать их избирательную чувствительность к Са-зависимой и Са-независимой протеиназной атаке. Протеинфосфатазы играют весьма важную роль в функционировании нервной ткани. Так, наряду с протеинфосфатазами 1, 2А, 2С, 2В и фосфатазным ингибитором 1 в мозге присутствуют эндогенные фосфатазы синапсина, миелина, Р-субъединицы А-киназы II типа, а также специфические ингибиторы фосфопротеинфосфатазной активности – DARPP-32 и G-субстрат, активность которых регулируется фосфорилированием. Можно думать, что в нервной ткани физиологическое действие нейромедиаторов в ряде случаев модулируется протеинфосфатазной активностью.
Выводы
1. G-белки сопрягают рецепторы клеток с системами, генерирующими вторичные посредники.
2. К вторичным посредникам относятся: цАМФ, цГМФ, инозитолфосфаты, диацилглицерол и ионы кальция.
3. Вторичные посредники активируют протеинкиназы, осуществляющие фосфорилирование определенных белков клетки, или воздействуют на метаболизм олигоаденилатов. Нейромедиаторы, гормоны и сам по себе нервный импульс регулируют фосфорилирование-дефосфорилирование многих регуляторных субстратов в нервной ткани. Огромное разнообразие физиологических эффектов, вызываемых этими агентами, обусловлено специфичностью систем протеинфосфорилирования, контролируемых различными вторичными посредниками.
4. Нервная ткань уникальна в отношении высокого содержания практически всех протеинкиназ, активность которых регулируется цАМФ, цГМФ, Са+, кальмодулином и фосфолипидами.
5. По субстратной специфичности все протеинкиназы и протеинфосфатазы в нервной ткани могут быть разделены на две основные категории. Протеинкиназа G, протеинкиназа В I типа, киназа легких цепей миозина, киназа фосфорилазы и кальцинейрин имеют узкую субстратную специфичность и принимают участие в специализированной нервной регуляции. Напротив, протеинкиназа А, киназа В II типа, С-киназа и ряд протеинфосфатаз проявляют широкую субстратную специфичность и вовлечены в регуляторные процессы практически всех типов нервных клеток.
6. Определенные протеинкиназы, протеинфосфатазы и их специфические субстраты локализованы не равномерно, а в специальных отделах нервной системы и в том числе мозга.
7. Вещества, активирующие синтез или ингибирующие гидролиз цАМФ, оказывают на нервные клетки антипролиферативное действие, связанное с влиянием этого нуклеотида на систему метаболизма 2', 5'-олигоаденилатов.
Похожие работы
... роль нейрорецепторов сводится к созданию специфических информационных входов, организующих единый функциональный ансамбль нейронов. Именно совокупность рецепторов определяет лицо клетки и ее реакции на поступление разнообразных химических сигналов. Молекулярные механизмы, лежащие в основе модуляции эффективности синаптической передачи, в которых важную роль играют рецепторные процессы, имеют ...
... мышление и др., а также индивидуальные особенности (способности). Таким образом, проблема научения является одной из фундаментальных в психологии вообще и психофизиологии в частности, поскольку она позволяет понять психическую адаптацию человека к условиям существования, сколь бы они ни были необычными, своеобразными, чрезвычайными. В непосредственной связи с научением находится проблема памяти. ...
... плотно смыкаются друг с другом и практически полностью обвертывают кровеносный сосуд. Подобная изоляция сосуда является одним из способов формирования гематоэнцефалического барьера - граници между кровью и нервной тканью, закрытой для многих находящихся в крови веществ. Другие отростки астроцита почти целиком обвертывают тела нейронов. Если нейрон возбуждается длительно, вокруг него повышается ...
... . И.П. Павлову, первому из русских ученых, 7 октября 1904 г. была присуждена Нобелевская премия в знак признания его работ по физиологии пищеварения. Потребность организма в пище проявляется в виде физиологической реакции голода. У человека голод приобретает выраженную субъективную окраску — от относительного безразличия к пище до яркой эмоциональной реакции. Физиологической основой голода ...
0 комментариев