Навигация
Са-кальмодулинзависимое протеинфосфорилирование
3. Са-кальмодулинзависимое протеинфосфорилирование
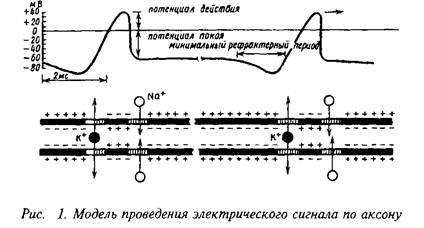
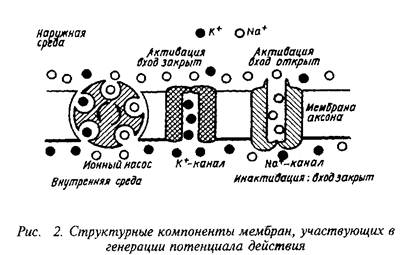
Как упоминалось, в процессе эволюции выработались эффективные механизмы удаления Са+ во внеклеточное пространство или специализированные внутриклеточные структуры. Низкая внутриклеточная концентрация Са+ позволила клеткам использовать "впрыскивание" Са+ в цитоплазму как сигнал на внешние воздействия. При этом кальций может быть даже более универсальным внутриклеточным регулятором, чем цЛМФ. Так, период действия Са+ очень короток и измеряется миллисекундами, а не секундами, как в случае цАМФ. Как стало понятно в последнее время, обе системы вторичных посредников функционируют в тесном взаимодействии.
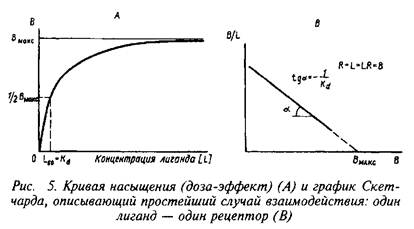
Для внутриклеточной "реализации" кальциевого сигнала в процессе эволюции созданы специальные внутриклеточные белковые рецепторы Са+, способные опосредовать действие этого иона на молекулярные мишени. Основным рецептором Са+ во всех клетках является кальмодулин. Кальмодулин – глобулярный белок сМг – 16,5 кД. Структурно он очень консервативен: так, обнаружено только шесть или немногим более аминокислотных замен в кальмодулине, выделенном из живых объектов, эволюционно разделенных миллионами лет. Кальмодулин содержит 4 Са-связывающих участка: в состав каждого из этих участков входят кислые остатки аминокислот, необходимые для связывания Са+ и обусловливающие низкое значение изоэлектрической точки KM. Фосфорилированных форм КМ не обнаружено.
Кальмодулин локализован главным образом в цитоплазме, а также ассоциирован с различными клеточными структурами, микротрубочками и мембранами, включая постсинаптические мембраны. Внутриклеточное распределение КМ регулируется циклическими нуклеотидами. Так, цАМФ-зависимый транспорт Са+ через клеточные мембраны может изменять сродство КМ к мембранной и цитоплазматической фракциям клетки.
При стимулировании происходит связывание Са+ с КМ. В результате кальмодулин претерпевает конформационные изменения: экспонирование гидрофобного участка при этом – важное условие для последующего взаимодействия КМ с акцепторными белками. Среди ферментов-исполнителей, активность которых модулируется в присутствии КМ, непосредственное отношение к регуляторным реакциям внутриклеточного протеинфосфорилирования имеют Са-КМ-зависимые протеинкиназы, аденилатциклаза, фосфодиэстераза циклических нуклеотидов и КМ-зависимая протеинфосфатаза.
На первый взгляд, способность КМ во многих тканях активировать системы как синтеза, так и деградации цАМФ выглядит парадоксом. Однако локализация ферментов аденилатциклазы в мембране, а фосфодиэстеразы в интозоле обусловливает преимущественную Са-активацию аденилатциклазы. Кроме того, для полной активации аденилатциклазы достаточно комплекса КМ-Са+, а для фосфодиэстеразы необходимо заполнение третьего, а возможно, и четвертого Са-связывающего участка КМ. Это означает, что аденилатциклаза активируется при более низких концентрациях Са+.
Результатом действия Са+ и кальмодулина часто является фосфорилирование, катализируемое Са-КМ-зависимыми протеинкиназами. К настоящему времени обнаружено 3 тина КМ-зависимых протеинкиназ В, которые в порядке убывания молекулярной массы обозначаются как протеинкиназы В I, II и III. Основные различия этих типов протеинкиназы В относятся к их субстратной специфичности. Так, протеинкиназа В I типа фос-форилирует лишь несколько белков в нервной ткани, в то же время для киназы II типа только в головном мозге найдено более 10 субстратов. Сродство этих протеинкиназ к КМ практически одинаково, что свидетельствует об одинаковой структуре КМ-узнающего участка фермента.
В нервной ткани, где концентрация Са-КМ-зависимых протеинкиназ особенно высока, обнаружены специфические изоферменты В-киназ I и II типа. Так, в мозге быка найдено, по меньшей мере, 3 изофермента В-киназы I типа. Высокомолекулярные олигомерные В Н-киназы из лобных долей мозга и мозжечка отличаются по субъединичному составу. Если первый фермент состоит из субъединиц а и р с Мг = 50/55 и 60/65 кД в молярном соотношении 3:1, то В-киназа из мозжечка имеет другое соотношение этих субъединиц – 1:4. Гетерогенность и высокая концентрация В-киназ в нервной ткани может обусловливать физиологическую значимость Са-КМ-зависимого фосфорилирования в клетках нервной системы.
Как установлено, протеинкиназа В II типа составляет примерно 0,4% от общего белка головного мозга млекопитающих, что свидетельствует о важной регуляторной роли фермента в этом отделе ЦНС. В-киназа II типа преимущественно связана с мембранной фракцией в отличие от "цитоплазматической" киназы В I типа. Мембраносвязанный фермент II типа сконцентрирован в области постсинаптического уплотнения в тех отделах нервной системы, которые связаны с обучением. Киназа В II типа обладает свойствами двухфазного переключателя со стабильностью, необходимой для кодирования долговременной памяти.
КМ-зависимые протеинкиназы могут быть разделены на 2 группы по структурным особенностям. Так, в одной группе КМ является интегральной частью фермента, а в другой – способен обратимо диссоциировать от протеинкиназы. Примером первого случая может служить киназа фосфорилазы, [Три активации фермента Са+ связывается с субъединицей фермента, являющейся кальмодулином. Около 20 лет назад было обнаружено стимулирующее действие на киназу фосфорилазы протеинкиназы А. К настоящему времени установлено, что 10–20 кратное увеличение активности фермента может быть вызвано цГМФ-зависимой и КМ-зависимой протеинкиназами. Участие экзогенного КМ в регуляции активности киназы фосфорилазы происходит только при отсутствии стимулов, приводящих к увеличению внутриклеточного содержания цАМФ. Гликоген и ферменты его метаболизма присутствуют в глии и нейронах: электростимулируемое расщепление гликогена в нервной ткани регулируется посредством активации киназы фосфорилазы.
Киназа легких цепей миозина является представителем второй группы КМ-зависимых протеинкиназ. Регуляция с помощью КМ-киназы легких цепей миозина осуществляется по принципу "все или ничего". Так, в отсутствие КМ фермент практически не активен, а при действии комплекса Са-КМ его активность возрастает в 200–300 раз. Установлено, что АТФазная активность актомиозина мозга увеличивается в 2–3 раза при фосформировании миозина киназой легких цепей.
Как упоминалось, активность КМ-зависимых протеинкиназ модулируется аутофосфорилированием. Аутофосфорилирование 2 субъединиц киназы фосфорилазы приводит к значительному увеличению ее активности. Аутофосфорилирование регулирует также компартментализацию В-киназ в нервных клетках, как это показано на нейронах аплизии. В присутствии комплекса Са-кальмодулин или цАМФ происходит транслокация активности В-киназы в цитозоль из мембраноцитоскелетной фракции. В-киназа тесно ассоциирована с определенными белками цитоскелета и мембран: фосфорилирование этих белков, как показано на препаратах мозга крыс, приводит к ослаблению сродства В-киназ к мембранам и цитоскелету.
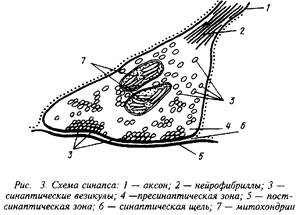
Очевидно, что изменения в содержании цитоплазматического Са+ имеют множественные последствия для синаптической функции, особенно для экзоцитоза. Мишенью ряда регулирующих экзоцитоз лекарственных препаратов и антител может быть кальмодулин. Установлено, что запускаемая деполяризацией секреция вазопрессина и окситоцина из нервных терминалей гипофиза является Са-зависимой и не требует участия цАМФ или протеинкиназы С, причем комплекс Са – кальмодулин связывается с белками мембран секреторных гранул, представляющими собой, вероятно, субъединицы специфичной протеинкиназы. Следствием этого процесса является усиление экзоцитоза посредством слияния мембран секреторных гранул с цитоплазматической мембраной.
В секреции нейромедиаторов принимают участие протеинкиназы В I и II типа, а также протеинкиназы А и С. Взаимодействие этих протеинкиназ отчетливо проявляется при фосфорилировании синапсинов – специфических белков синаптических структур. Один из этих белков – синапсин I, составляющий 6% от общего белка высокоочищенных синаптических везикул и являющийся своеобразным "мостиком" между везикулами и цитоскелетом, фосфорилируется протеинкиназой В I типа и протеинкиназой А по одному остатку серина. Два других остатка серина в молекуле синапсина I фосфорилирует протеинкиназа В II типа и, вероятно, протеинкиназа С. В нейронах найден так называемый протеин-Ш – белок, также связанный с синаптическими мембранами и по ряду свойств напоминающий синапсин I. Протеин-Ш по единственному остатку серина фосфорилируют как протеинкиназа А, так и протеинкиназа В I типа. Очевидно, цАМФ- и Са-зависимое фосфорилирование синапсина I и протеина-III обеспечивает регуляцию секреции нейромедиаторов. Так, инъекция в синапс В-киназы II типа увеличивает секрецию, в то время как инъекция дефосфорилированного синапсина I угнетает высвобождение нейромедиаторов. Для эффективной секреции необходимо одновременное фюсфорилирование синапсина I А-, В- и С-киназами. Секреция нейромедиаторов регулируется, по-видимому, разрывом связи фосфорилированного синапсина I с актином и тубулином. В результате везикулы высвобождаются из комплекса с белками цитоскелета и становится возможной Са-индукция экзоцитоза. Предполагается также, что сконцентрированные в синаптических окончаниях молекулы В-киназы II типа сами по себе являются стерическим препятствием для высвобождения медиаторов из секреторных везикул. Аутофосфорилирование киназы способствует ее диссоциации на субъединицы и, таким образом, стимулирует секрецию.
Важную роль в функционировании нейронов играет совместное фосфорилирование протеинкиназами А II типа и В II типа высокомолекулярного белка МАР-2, сконцентрированного в дендритах нейронов. Как упоминалось, именно здесь локализована Р-субъединица А-киназы II типа, которая обладает высоким сродством к МАР-2 и является своеобразным "якорем" цАМФ-зависимой фосфорилирующей активности в дендритах. МАР-2 участвует в сборке микротрубочек: фосфорилирование этого белка киназами В и АII типа контролирует процесс сборки и, таким образом, может модулировать функциональную активность нейронов. МАР-2 фосфорилирует также протеинкиназа С; роль этого процесса в функционировании нейронов выясняется.
Предполагается, что комплекс МАР-2 – Р-субъединица А-киназы II типа может изменять проницаемость мембран нейронов для Na+ и К+ без фосфорилирования К-субъединицей киназы. Возможно, сигналом для такого изменения мембранной проницаемости является взаимодействие цАМФ с Р-субъединицей протеинкиназы II типа, ассоциированной с МАР-2. Сигнал распространяется по цитоскелету к мембране нейронов с очень высокой частотой; для поддержания такой частоты достаточное время требуется энергия АТФ.
Синергизм в действии протеинкиназ В и А в нервной ткани проявляется также при потенцировании цАМФ-индуцируемых входящих токов внутриклеточными ионами Са. Повышение внутриклеточной концентрации цАМФ в нейронах виноградной улитки приводит к деполяризации мембраны, а в условиях фиксации потенциала – к возникновению ионного тока по каналам пассивной проницаемости. Увеличение внутриклеточной концентрации Са+ приводит к значительному увеличению амплитуды и длительности цАМФ-тока.
Можно полагать, что синергическое действие Са+ и иАМФ на соответствующие ионные каналы связано с наличием у последних двух различных участков фосфорилирования; для В- и А-киназ. Возникающие под влиянием КМ-зависимого фосфорилирования изменения в структуре канала обеспечивают повышение доступности соответствующего участка фосфорилирования для протеинкиназы А. Напротив, при изучении влияния внутриклеточного Са+ на Са-зависимые калиевые каналы взаимодействие двух систем вторичных посредников отличается тем, что цАМФ выступает в роли агента, повышающего чувствительность канала к внутриклеточному Са+ и КМ. Можно полагать, что регуляция числа каналов и их активности с помощью протеинфосфорилирования связана с изменениями в процессах поведения и обучения.
В последнее время появились данные о регуляции протеинкиназной и протеинфосфатазной активности с помощью Са-связывающего белка S-100. S-100 активирует фосфопротеинфосфатазы мозга, а также модулирует активность ядерных и цитоплазматических протеинкиназ этой ткани, в частности К-субъединицы протеинкиназы A. S-100 ингибирует фосфорилирование ряда субстратов в клетках мозга; кальмодулин активирует фосфорилирование этих же белков. Возможно, S-100 и кальмодулин действуют в мозге как антагонисты. Во всяком случае, в нервной ткани реализуется еще один путь Са-зависимого фосфорилирования-дефосфорилирования, независимый от КМ-стимулируемого процесса. S-100-стимулируемое фосфорилирование-дефосфорилирование может принимать участие в регуляции ряда функций нервных клеток.
Необходимо отметить участие В-киназы II типа наряду с протеинкиназой А в фосфорилировании и соответствующей активации т! фозингидроксилазы, что приводит к ускорению синтеза катехоламинов в ответ на нервный импульс и нейромедиаторный сигнал. Установлено, что тршггофангидроксилаза – фермент, катализирующий первую реакцию биосинтеза серотонина, также фосфорилируется протеинкиназой В II типа. Фосфорилирование триптофангидроксилазы приводит к двукратному увеличению ее активности. Таким образом, Са-КМ-зависимое фосфорилирование ферментов, принимающих участие в синтезе нейромедиаторов и гормонов, является одним из ключевых аспектов участия В-киназ в нейрогуморальной регуляции.
Отметим, что на основании результатов многочисленных исследований установлена тесная взаимосвязь между процессами, регулируемыми Са+, цАМФ и 2–5А. Это дает основание для их рассмотрения в рамках единой регуляторной системы. Взаимодействие Са+, цАМФ и 2–5А обусловлено двумя типами регуляторных связей. Во-первых, ряд жизненно важных для клеток реакций контролируется этими вторичными посредниками одновременно. Так, например, активность киназы фосфорилазы гликогена зависит от цАМФ и Са+, скорость синтеза белка полирибосомами контролируется с помощью фосфорилирования А-киназой и уровнем 2–5А и т.д. Во-вторых, увеличение внутриклеточного уровня одного из посредников приводит к изменению содержания других. Так, возрастание уровня пАМФ обусловливает индукцию олигосинтетазы и ингибирование 2'-фосфодиэстеразы, что приводит к увеличению концентрации 2–5А. В свою очередь, Са* и 2–5А активируют фосфодиэстеразу цАМФ и тем самым вызывают падение уровня цАМФ. Кроме того, увеличение внутриклеточного уровня цАМФ приводит к выбросу Са+ из митохондрий в цитоплазму и высвобождению кальмодулина из примембранных компартментов.
4. Са+-фосфолипид-зависимое протеинфосфорилирование
Похожие работы
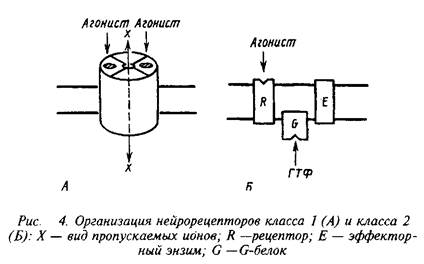
... роль нейрорецепторов сводится к созданию специфических информационных входов, организующих единый функциональный ансамбль нейронов. Именно совокупность рецепторов определяет лицо клетки и ее реакции на поступление разнообразных химических сигналов. Молекулярные механизмы, лежащие в основе модуляции эффективности синаптической передачи, в которых важную роль играют рецепторные процессы, имеют ...
... мышление и др., а также индивидуальные особенности (способности). Таким образом, проблема научения является одной из фундаментальных в психологии вообще и психофизиологии в частности, поскольку она позволяет понять психическую адаптацию человека к условиям существования, сколь бы они ни были необычными, своеобразными, чрезвычайными. В непосредственной связи с научением находится проблема памяти. ...
... плотно смыкаются друг с другом и практически полностью обвертывают кровеносный сосуд. Подобная изоляция сосуда является одним из способов формирования гематоэнцефалического барьера - граници между кровью и нервной тканью, закрытой для многих находящихся в крови веществ. Другие отростки астроцита почти целиком обвертывают тела нейронов. Если нейрон возбуждается длительно, вокруг него повышается ...
... . И.П. Павлову, первому из русских ученых, 7 октября 1904 г. была присуждена Нобелевская премия в знак признания его работ по физиологии пищеварения. Потребность организма в пище проявляется в виде физиологической реакции голода. У человека голод приобретает выраженную субъективную окраску — от относительного безразличия к пище до яркой эмоциональной реакции. Физиологической основой голода ...
0 комментариев