Навигация
Получение ДНК-фрагментов желаемого размера
2.3 Получение ДНК-фрагментов желаемого размера
ДНК, подвергаемая частичному гидролизу, должна быть достаточно высокомолекулярной. Методика приготовления образцов ДНК та же, что и для пульс-электрофореза, с той лишь разницей, что количество ДНК рассчитывается для препаративных целей.
1. Исходя из того, что одна клетка млекопитающего содержит 6,7 пкг ДНК, необходимо вырастить их столько, чтобы получить достаточное количество ДНК. Обычно для создания библиотеки требуется 200 мкг ДНК, что соответствует приблизительно 3х107 клеткам. ДНК должна быть очень высокого качества, поэтому очень важно растить клетки в оптимальных условиях. Можно приготовить клетки и из периферической крови центрифугированием в смеси Ficoll-Hypaque.
2. После сбора клеток аккуратно просчитайте их количество в гемоцитометре и суспендируйте в таком объеме фосфатно-солевого буфера, чтобы концентрация клеток составляла примерно 2хЮ7/мл. Затем суспензию быстро смешайте с равным объемом расплавленной 2%-ной низкоплавкой агарозы в 125 мМ ЭДТА при 40°С. Залейте в форму. Кроме стандартных ячеек форма должна иметь ячейки для блоков размером 2x8x135 мм, которые служат для получения ДНК в препаративных количествах. Полезно приготовить 10–20 стандартных блоков с ДНК для тест-гидролизатов и два больших блока непосредственно для опытов.
3. Обработайте ДНК протеиназой К в присутствии больших количеств ЭДТА и N-лаурилсаркозина, как описано ранее.
4. Очищенную ДНК проверьте на нативность и на присутствие нуклеаз. Для этого инкубируйте половину содержимого блока при 37°С 3 ч с 10 мм MgCl2 и нанесите эту смесь, а также необработанную половину на OFAGE-гель или на гель для электрофореза в инвертированном поле. Определите размер ДНК. Необработанная ДНК должна практически полностью остаться в лунке, а в обработанном магнием препарате не должно быть низкомолекулярных примесей. Только в этом случае можно использовать препараты для «прыжков по хромосоме». Если же в препаратах, обработанных магнием, налицо признаки деградации, значит они загрязнены нуклеазами и надо повторить обработку протеиназой К. Как правило, этого бывает достаточно, чтобы избавиться от загрязнений.
5. Из некоторых источников ДНК постоянно выделяется с небольшим количеством низкомолекулярных примесей размером 50–100 т. п.н., видимо из мертвых клеток. Наиболее характерно это для лимфобластов. Такие деградировавшие молекулы ДНК могут сильно искажать результаты «прыжков по хромосоме», поэтому необходимо удалить их из агарозных блоков перед обработкой рестриктазами. Для этого блоки помещают в лунки OFAGE-геля и проводят пульс-электрофорез в течение 2–3 ч с интервалами между импульсами 20 с. Молекулы ДНК размером менее 100 т. п.н. выходят из блоков в гель, а высокомолекулярная ДНК остается практически без изменения. Блоки затем можно изъять из геля, получив, таким образом, высококачественный материал для дальнейшего исследования.
6. Проведите контрольную рестрикцию половинок агарозных блоков различными концентрациями Mbol. Согласно данной методике, в каждой половине блока содержится примерно 3,3 мкг ДНК, следовательно, концентрация фермента составит от 0,01 ед./мкг до 0,045 ед./мкг. Остановите реакцию добавлением 10 мкл ЭДТА. Обработанные рестриктазой образцы поместите в гель и проведите пульс-электрофорез. Это поможет определить концентрацию фермента, оптимальную для получения фрагментов нужного размера. На рисунке наглядно продемонстрирована необходимость пре-электрофореза для удаления низкомолекулярных примесей ДНК перед обработкой рестриктазами.
7. При использовании больших агарозных блоков пропорционально увеличьте количество фермента, но так, чтобы концентрации фермента в ед./мкл и ДНК в мкг/мл остались прежними.
8. Обработанные рестриктазой препаративные блоки поместите в гель и, используя соответствующие маркеры, проведите пульс-электрофорез с интервалами между импульсами, позволяющими хорошо отделить фрагменты нужной величины.
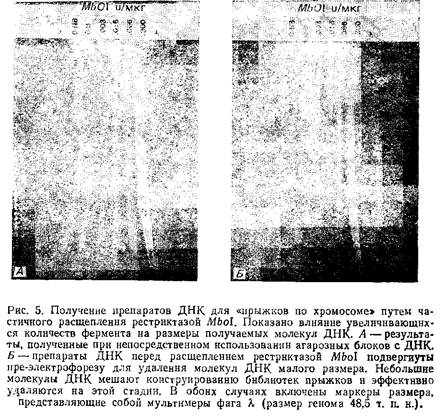
Если используется OFAGE-гель, маркеры следует наносить в середине и по обоим краям геля. Мы обнаружили, что для получения прямых полос молекул ДНК желаемых размеров лучше использовать CHEF-гели и гель-электрофорез в инвертированном поле.
9. Важно, чтобы ДНК, которую предстоит клонировать, не подвергалась ультрафиолетовому облучению. Поэтому отрежьте края геля, содержащие маркеры, а также небольшое количество рестрицированной геномной ДНК, окрасьте их бромидом этидия и визуализируйте в ультрафиолете. По полученным данным определите участок геля с интересующей вас ДНК.
10. Вырежьте нужный участок геля. На этой и последующих стадиях важно использовать безнуклеазные реактивы и инструменты. Выделять ДНК из геля для получения кольцевой молекулы можно двумя способами. Нам представлялось удобным делать это методом электроэлюции. Поместите кусочек геля с ДНК в диализный мешок, залейте четырьмя объемами электрофорезного буфера, а затем поместите мешок в камеру для горизонтального электрофореза. Элюируйте ДНК из геля в течение двух часов 0,5хТВЕ-буфером при постоянном напряжении 100 В. Чтобы убедиться, что вся ДНК элюирована, можно вскрыть диализный мешок, достать гель и окрасить бромидом этидия. После удаления геля снова запечатайте диализный мешок и отдиали-зуйте ДНК против 10 мм Трис, рН 7,4, 1 мм ЭДТА с несколькими сменами буфера, подготовив таким образом препарат для лигирования.
11. Препаративные гели для определения размеров ДНК можно готовить из легкоплавкой агарозы. И тогда выделять ДНК из них можно, вырезая нужные участки и расплавляя их при 65°С. После того как гель расплавится, ДНК доводят до нужной концентрации и проводят лигирование в присутствии агарозы, которая не ингибирует эту реакцию. В настоящее время нет оснований предпочитать один метод другому. Важно лишь избегать операций, которые могли бы нарушить целостность молекул ДНК после извлечения их из геля. Нельзя центрифугировать, встряхивать, пипетировать препараты. И желательно как можно скорее приступать к их лигированию.
Похожие работы
... , вызванные динамическими му-тациями.-----------------------T-----------T-------T-----T------T------T----------------------¬ Болезнь, номер по ¦ Ген, лока-¦Триплет¦Норма¦Прему-¦Мута- ¦Литература ¦ МакКьюсику (MIM) ¦ лизация ¦ ¦ ¦тация ¦ция ¦ ¦ -----------------------+-----------+-------+-----+------+------+----------------------+ Синдром ломкой X-хро- ¦FMR1, FRAXA¦(CGG)n ...
... , в нашем геноме есть масса повторяющихся участков. Действительно, очень интересно, почему человек - "венец эволюции" имеет огромную долю "неработающего" генома. Рис. 2. Примерное распределение генов человека по их функциям. 1 – производство клеточных материалов; 2 – производство энергии и ее использование; 3 – коммуникации внутри и вне клеток; 4 – защита клеток от инфекций и повреждений; 5 – ...
... школьной гигиены - изучение способов охраны здоровья, гигиенических принципов организации учебно-воспитательного процесса, направленных на сохранение здоровья школьников. Школьная гигиена тесно связана с возрастной физиологией (физиологией детей и подростков), педагогикой, психологией. Она охватывает широкий круг вопросов, имеющих здравосберегающее значение для школьников. Содержание школьной ...
... в практику, должны быть разработаны методы для установления степени риска либо в отдельных семьях, либо путем скринирования всех родителей. Это изменит назначение медицинской генетики от генетики, консультирующей ретроспективно, к службе генетического предупреждения на перспективной основе. Может возникнуть новое отношение к ответственности родителей к воспроизводству потомства, которое вместе с ...
0 комментариев