Навигация
2.4 Циклизация
Успех или неудача «прыжков по хромосоме» в решающей степени определяются возможностью лигировать большие сегменты ДНК с образованием кольцевых молекул. Анализ стратегии этого метода, схематически изображенной на рис. 4, показывает, что тандемное лигирование молекул ДНК дает сцепленные фрагменты, соединяющие в себе две случайные последовательности. Такое сцепление приводит к образованию аномальных клонов, которые провоцируют «прыжки по хромосоме» из данной стартовой точки на какую-то случайную последовательность генома. Свести к минимуму риск возникновения такого события можно, проводя лигирование при достаточно низких концентрациях ДНК так, чтобы на долю тандемных лигирований приходилось менее 5–10%.
Теория лигирования ДНК при низких концентрациях была разработана в 50-е годы Джекобсоном и Стокмайером. Для некоторых размеров последовательностей ДНК теоретические прогнозы подтвердились экспериментально. Очень полезно, например, следующее соотношение:
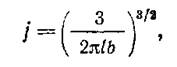
где j – концентрация молекул ДНК контурной длины / и сегментной длины b, при которой с равной вероятностью лигируются как разные молекулы, так и концы одной молекулы. Очевидно, что для эффективной циклизации лучше работать с концентрациями гораздо более низкими, чем /. Подставляя в уравнение известные параметры ДНК для водного раствора, его можно преобразовать следующим образом:
![]()
где т.п.н. – длина ДНК в тысячах пар нуклеотидов. При данной концентрации ДНК i – доля лигирований, приводящих к циклизации. Чтобы эта доля достигала 90%, работать следует с концентрацией ДНК, определяемой уравнением:
![]()
Обычно для получения 3х106 клонов в библиотеке, необходимо после расщепления циклизованных молекул ДНК иметь 0,5 мкг сцепленных фрагментов. Средний размер такого фрагмента 5 т. п.н., а это значит, что для осуществления прыжков в 100 т. п.н. необходимо иметь 10 мкг фракционированной по размеру ДНК; для прыжков в 200 т. п.н. – уже 20 мкг. На интенсивность лигирования влияют два фактора: 1) количество ДНК, необходимое для получения достаточного числа сцепленных фрагментов и создания геномной библиотеки. Это количество возрастает линейно с увеличением размера прыжка; 2) необходимость преимущественного получения циклизованных молекул. Интенсивность лигирования с циклизацией возрастает пропорционально квадратному корню длины молекул ДНК. Поэтому с увеличением размера прыжка объем лигазной смеси должен возрастать пропорционально 3/2 степени длины молекулы ДНК. В табл. 1 приведены стандартные параметры для создания геномной библиотеки, рассчитанной на прыжки в 100 т. п.н.
Очень важно маркировать в кольцевых молекулах места соединения фрагментов с тем, чтобы селективно клонировать их на последующих стадиях. В качестве селективного маркера мы использовали ген супрессорной тРНК – supF, хотя возможны и другие способы селекции. Супрессорный ген должен иметь концы, комплементарные Mfeol-концевым фрагментам геномной ДНК – Для этой цели было взято несколько supF с различающимися концевыми последовательностями, полученными при обработке рестриктазной Ват.
Ниже представлена методика реакции циклизации.
1. Используя приведенные выше уравнения, растворите ДНК и доведите раствор до нужной концентрации в 50 мМ Трис, рН 7,4, 1 мМЭДТА.
2. Добавьте 100 или 500-кратный молярный избыток ДНК BamHI-фрагмёнтов supF, предварительно проверенных на эффективность лигирования. Для этого проведите самолигирование и последующий анализ геля. По нашему мнению, наиболее удобно получать фрагменты генов supF электрофорезом с последующей электроэлюцией. Важно, чтобы фрагмент был максимально очищен от плазмиды, поскольку даже незначительные количества ее могут проявиться в окончательной библиотеке в виде клонов, гибридизующихся с зондом, несущим плазмиду. Оставьте смесь supF ДНК с геномной ДНК на полчаса.
3. Доведите концентрацию магния до 10 мМ и оставьте смесь еще на 10 мин, чтобы установилось равновесие. Затем добавьте ДНК-лигазу бактериофага Т4 до конечной концентрации 1–2 ед./мкл. Лигируйте 12 ч при 14°С, затем добавьте вторую порцию лигазы и лигируйте еще 12 ч. Осадите циклизовавшуюся ДНК этанолом, добавив 20 мкг дрожжевой тРНК-носителя. Отцентрифугируйте осадок при 23000 об/мин в роторе SW27. Ресуспендируйте осадок в 100 мкл ТЕ и инактивируйте все нелигировавшиеся концы, либо обработав их щелочной фосфатазой, либо добавив фрагмент Клёнова ДНК-полимеразы I. Эта стадия очень важна, так как, если лигирование при низких концентрациях происходит не полностью, свободные фрагменты могут аномально лигироваться с вектором. Экстрагируйте ДНК фенолом, осадите и, растворив, снова обработайте EcoRl.
5. Для контроля очень полезно на каждой стадии отбирать небольшие аликвоты и подвергать их электрофорезу в 1,4%-ном агарозном геле с последующим переносом на нитроцеллюлозу или полиамид и блот-гибридизацией с supF-гтом. В случае успешной реакции циклического лигирования ДНК гена supF будет давать полосы в виде лестницы, и небольшое ее количество должно оказаться в той зоне геля, которая соответствует высокомолекулярной ДНК. После обработки рестриктазой ЕсоЩ лесенка supF-гена должна остаться, а полосы из высокомолекулярной области должны расщепиться на множество фрагментов размером от 1 до 20 т. п.н.
6. ДНК, обработанную ЕсоШ, экстрагируйте фенолом и осадите этанолом.
2.5 Клонирование и скрининг
На этой стадии обработанные кольцевые молекулы геномной ДНК уже можно лигировать и производить селекцию сцепленных фрагментов. Для селекции геномные фрагменты встраивают в фаговый вектор, несущий амбермутации по крайней мере двух генов белковой оболочки, упаковывают фаговую ДНК in vitro и инфицируют клетки бактерии-хозяина, лишенные функции supF. Формировать бляшки на таком газоне могут только те фаговые частицы, геномы которых содержат собственные supF-гены.
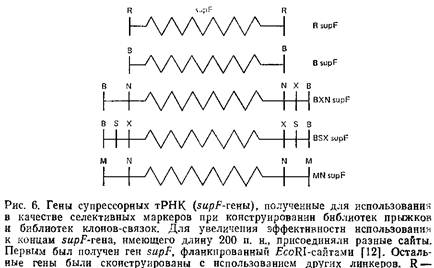
Теоретически подходит любой фаговый вектор, несущий амбер-мутации и клонирующий сайт. Желательно, конечно, чтобы этот вектор обеспечивал максимальную клонирующую емкость. Идеальной можно считать ситуацию, когда кольцевые геномные фрагменты расщеплялись бы лишь частично мелкощепящим ферментом, а затем лигировались в вектор большой емкости, чтобы не было дискриминации фрагментов, обусловленной расположением сайтов рестрикции. Однако обязательные потери, происходящие при частичном расщеплении, оказываются препятствием на пути создания полной библиотеки. Имеющиеся у нас в настоящее время стандартные геномные библиотеки для «прыжков по хромосоме» были получены в результате полного расщепления кольцевых геномных фрагментов рестриктазой EcoRl. Можно использовать и другие ферменты, для которых имеются амбермутантные фаговые клонирующие векторы.
2.6 Анализ клонов
После очистки бляшек можно приготовить минилизат ДНК из клонов, руководствуясь любой стандартной методикой. Использование на этой стадии в качестве газона LE392 позволяет получить несколько больший выход фаговой ДНК, чем при посеве на МС1061. Обработка рестриктазой ЈcoRI позволит определить размер инсерционного фрагмента. Если в данном клоне имеется более одного fcoRI-фрагмента, это значит, что при клонировании в один вектор были лигированы две вставки. В таком случае следует провести блот-гибридизацию данного клона с исходным зондом и с supF, чтобы определить, находятся ли эти вставки в одном EcoRI-фрагменте или в разных. В первом случае с клоном можно продолжать работать дальше традиционными методами; во втором случае он не представляет ценности для дальнейших исследований.
ZTcoRI-фрагмент полезно переклонировать в плазмиду, чтобы упростить работу по его изучению. Субклоны можно легко идентифицировать, благодаря наличию SHpF-маркера. Рестрицированный минилизат ДНК можно лигировать в pBR322, предварительно обработанную ЈcoRI и фосфатазой, и полученной рекомбинантной ДНК трансформировать штамм бактерии-хозяина, несущий какую-либо амбермутацию в lacZ, например CARD-15. Высев культуры на агар Мак-Конки с ампициллином позволяет практически сразу выявить интересующие колонии, так как они способны сбраживать лактозу и окрашены в пурпурный цвет в отличие от остальных, шмеющих розовую окраску.
Для того чтобы разделить стартовую и конечную точки прыжка, очень полезно использовать присутствие сайта в центре гена supF. Особенно эффективно это в том случае, когда имеющийся в pBR322 сайт Aval элиминирован. Мы добивались этого, проводя последовательно обработку плазмиды рестриктазой Aval, достраивание фрагментом Клёнова и повторное лигирование. Отделить половины клонированного фрагмента можно, обрабатывая субклоны EcoRl, Aval и обеими рестриктазами одновременно. Лиасайты встречаются иногда в геномных последовательностях, что несколько затрудняет составление карты. Однако при помощи блот-гибридизации рестрицированных субклонов с исходным зондом, supF и геномной ДНК человека, позволяющей локализовать повторы, обычно легко удается построить рестрикционную карту и идентифицировать уникальные последовательности. А это, в свою очередь, позволяет определить, является ли данный прыжок эффективным. Результаты блот-гибридизации представляют особый интерес, так как с их помощью удается идентифицировать ближайшие к супрессорному гену фрагменты.
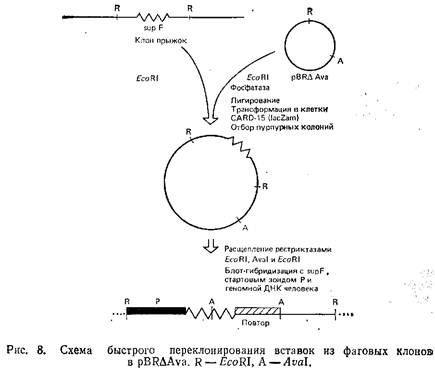
В случае же использования supF с дополнительными вставками редко встречающихся сайтов рестрикции разделение половинок фрагмента, составляющего прыжок, упрощается, и зонды можно получать непосредственно из минилизатафаговой ДНК. После того как установлено, что фрагмент – «прыжок» представлен в геноме единичной копией, надо провести его гибридизацию с блотом геномной ДНК из гибридных соматических клеток, чтобы убедиться, что прыжок осуществлен в пределах нужной хромосомы. Это очень важный момент, так как при создании геномной библиотеки всегда существует опасность нециклического лигирования.
Похожие работы
... , вызванные динамическими му-тациями.-----------------------T-----------T-------T-----T------T------T----------------------¬ Болезнь, номер по ¦ Ген, лока-¦Триплет¦Норма¦Прему-¦Мута- ¦Литература ¦ МакКьюсику (MIM) ¦ лизация ¦ ¦ ¦тация ¦ция ¦ ¦ -----------------------+-----------+-------+-----+------+------+----------------------+ Синдром ломкой X-хро- ¦FMR1, FRAXA¦(CGG)n ...
... , в нашем геноме есть масса повторяющихся участков. Действительно, очень интересно, почему человек - "венец эволюции" имеет огромную долю "неработающего" генома. Рис. 2. Примерное распределение генов человека по их функциям. 1 – производство клеточных материалов; 2 – производство энергии и ее использование; 3 – коммуникации внутри и вне клеток; 4 – защита клеток от инфекций и повреждений; 5 – ...
... школьной гигиены - изучение способов охраны здоровья, гигиенических принципов организации учебно-воспитательного процесса, направленных на сохранение здоровья школьников. Школьная гигиена тесно связана с возрастной физиологией (физиологией детей и подростков), педагогикой, психологией. Она охватывает широкий круг вопросов, имеющих здравосберегающее значение для школьников. Содержание школьной ...
... в практику, должны быть разработаны методы для установления степени риска либо в отдельных семьях, либо путем скринирования всех родителей. Это изменит назначение медицинской генетики от генетики, консультирующей ретроспективно, к службе генетического предупреждения на перспективной основе. Может возникнуть новое отношение к ответственности родителей к воспроизводству потомства, которое вместе с ...
0 комментариев