Навигация
Карта генетического сцепления генома человека
2. Карта генетического сцепления генома человека
Генетика человека существенно продвинется вперед с появлением полной карты сцепления. Такая карта будет состоять из маркеров ПДРФ, равномерно разбросанных по всем хромосомам, покрывая в целом около 3300 сантиморганид.
За последние несколько лет в этом направлении был сделан значительный шаг вперед. В конце 1987 г. Донис-Келлер сообщил о построении карты для 403 локусов генома человека, распределенных по всем группам сцепления соответственно числу хромосом. В это же время Уайт распространил буклеты, содержащие 255-локусную карту, с группами сцепления, охватывающими 17 из 23 хромосом. Так как перекрывание между наборами маркеров, изученными в этих двух группах, невелико, возможно построение 600-локусной суммарной карты. Учитывая, что в настоящее время этими и другими группами исследователей картируется множество дополнительных ПДРФ-маркеров, представляется вполне реальным, что вскоре в нашем распоряжении окажется карта для более чем 1000 ПДРФ. Эта карта будет иметь в среднем по одному маркеру на каждые 3 см.
Такая плотная карта ПДРФ-маркеров чрезвычайно удобна для анализа человеческого генома.
1. Все без исключения семьи оказываются полностью информативными для анализа сцепления. Когда в анализе сцепления используются случайные и некартированные ПДРФ-маркеры, мейозы, происходящие у индивидов, гомозиготных по одному из них, не являются информативными для анализа сцепления ПДРФ-маркера с интересующим нас заболеванием. Наличие плотной карты позволяет, однако, выбирать в любом районе несколько близко расположенных ПДРФ таким образом, чтобы все индивиды были заведомо гетерозиготными хотя бы по одному из них. Получение такой информации позволяет осуществить анализ полилокусного сцепления с помощью компьютера.
2. Наследование локуса, ответственного за заболевание, можно проследить более строго, используя фланкирующие маркеры. Бели между маркерами, расположенными по обе стороны от предполагаемого локуса, ответственного за болезнь, рекомбинация не наблюдается, можно быть уверенным, что данный локус, расположенный между ними, наследовался совместно с этими маркерами. В действительности, в генетике давно уже считается, что анализ по таким тройным перекрестам много точнее, чем по двойным. Повышенная точность упрощает процедуру принятия или отклонения гипотезы, и таким образом, уменьшает необходимое для анализа количество семей.
3. Можно одновременно проследить наследование нескольких разных районов генома. Это позволяет установить сцепление в случае генетической гетерогенности заболевания.
Нам представляется, что в будущем анализ сцепления первоначально будет основан на использовании стандартного набора приблизительно 150–200 высокоинформативных ПДРФ-маркеров, распределенных по всему генному, с интервалом около 15–20 см. После того как все изучаемые родословные окажутся генотипировэнными по каждому маркерному локусу, будет проведен компьютерный анализ, тестирующий каждый такой участок на наличие шансов за сцепление. Любой фрагмент, предположительно сцепленный с изучаемым признаком, будет изучен затем более подробно с использованием плотной карты ПДРФ, например с плотностью один маркер на каждые 3 см. Это позволит извлечь всю информацию, заключенную в родословной, и увеличит величину лод-балла. Естественно, при планировании такого анализа вполне уместен вопрос: сколько семей необходимо, чтобы при наличии редкой карты ПДРФ уловить хотя бы намек на сцепление, а для плотной карты ПДРФ иметь возможность доказать с определенностью наличие сцепления?
3. Планирование анализа сцепления для болезней с простым типом наследования
Под простым типом наследования мы понимаем, что болезнь: 1) наследуется как классический менделеевский доминантный или рецессивный признак, проявляющий полную пенетрантность, и 2) вызвана мутациями в одном локусе. Данные точных эпидемиологических исследований заболевания обычно дают основания судить о том, справедливо первое условие или нет. В противоположность этому второе условие обычно следует принимать на веру: не существует такого мощного метода для доказательства того, что мутации по одному локусу являются причиной данного заболевания, и в то же время существует много поводов усомниться в этом. Но к данному вопросу мы вернемся позже, при обсуждении генетической гетерогенности.
Болезнь Гентингтона и муковисцидоз являются яркими примерами признаков с доминантным и рецессивным типом наследования, соответственно. Оказывается, что в обоих случаях болезнь – следствие мутаций единичного локуса.
Для заболевания с простым типом наследования относительно легко построить карту сцепления. Рассчитав сумму ELOD-баллов, можно прямо оценить требуемую величину выборки. На рис. А, Б показано число ядерных семей с двумя или тремя пораженными, которое требуется, чтобы гарантировать 50%-ную вероятность успеха при картировании доминантного или рецессивного признака. Это число является функцией плотности расположения используемых ПДРФ-маркеров. Рисунок демонстрирует количество семей, необходимое 1) в случае, когда несколько маркеров рестрикционного полиморфизма используются по отдельности, и 2) если задействован весь потенциал карты ПДРФ, т.е. используются фланкирующие маркеры. Как следует из рис. 1, необходимое количество семей вполне эффективно при наличии геномной карты ПДРФ, отстоящих друг от друга на расстоянии 20–30 см.
Далее мы рассмотрим признаки с более сложным типом наследования и обсудим проблемы, возникающие при их картировании с помощью анализа сцепления, и пути их преодоления.
Похожие работы
... , в нашем геноме есть масса повторяющихся участков. Действительно, очень интересно, почему человек - "венец эволюции" имеет огромную долю "неработающего" генома. Рис. 2. Примерное распределение генов человека по их функциям. 1 – производство клеточных материалов; 2 – производство энергии и ее использование; 3 – коммуникации внутри и вне клеток; 4 – защита клеток от инфекций и повреждений; 5 – ...
... только те страны и компании, которые в состоянии выложить за это значительные деньги. Бедные же страны, например африканские, могут оказаться отрезанными от достижений прогресса в геномике.Изучая проект «Геном человека» учёныё столкнулись с величайшим открытием века. Коротко об этом: Электромагнитный апокалипсис. Как это ни странно звучит, но в последние десятилетия в науке открылись такие ранее ...
... отклонениям в развитии организма. Например, цитогеническим методом установлены причины болезни Дауна у человека. Эту болезнь вызывает наличие лишней хромосомы в одной из хромосомных пар. В генетике человека нередко применяется генеалогический метод - изучение родословных. Он позволяет выявить доминированность или рецессивность гена, сцепленность генов между собой и с полом. В клетках человека ...
... придется смириться с определенным числом химически индуцированных мутаций, поскольку общество не может отказаться от тех преимуществ, которые дают ему достижения современной химии. В будущем человечеству придется столкнуться с увеличением частоты спонтанных мутаций. Оно приведет к соответствующему увеличению численных и структурных хромосомных аберраций и наследственных заболеваний, ...
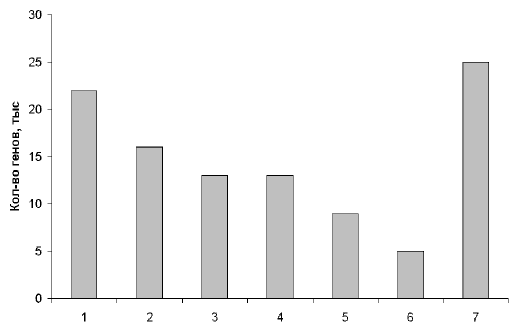




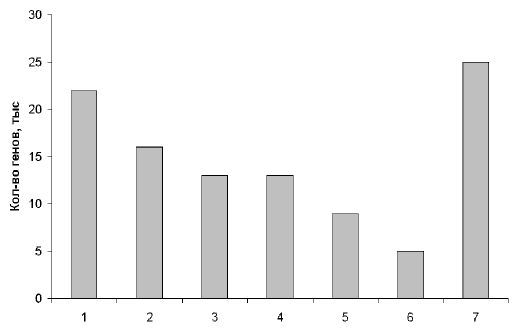
0 комментариев