Навигация
Осложнения: генетические взаимодействия
6. Осложнения: генетические взаимодействия
Некоторые признаки являются результатом генетического взаимодействия аллелей более чем одного локуса. Среди низших организмов это подтверждается множеством фактов, чего не скажешь о человеке. К примеру, известно, что проявление талассемии частично подавляется наличием fi-формы. Предполагается также, что по крайней мере некоторые из заболеваний, демонстрирующие частичную ассоциацию с генотипом HLA, могут быть обусловлены также и другими локусами.
Результатом генетического взаимодействия является и так называемый синтетический признак. Такой признак обусловлен несколькими «взаимодействующими» локусами, т.е. проявляется только при наличии соответствующих аллелей по всем вовлеченным локусам, в противном случае развивается абсолютно нормальный фенотип. По некоторым локусам мутантные аллели могут доминировать, по другим – быть рецессивными. Часть аллелей может встречаться редко, в то время как другие обнаруживаются в популяции с высокой частотой. Распространенность такого признака будет отражать произведение частот мутаций по всем локусам, участвующим в его детерминации.
Одна из возможных проблем при картировании локусов, вовлеченных во взаимодействие, заключается в том, что некоторые родители могут быть гомозиготными па одному из компонентных локусов, хотя и не будут проявлять интересующий признак из-за отсутствия нужного генотипа по другим локусам. Так как больной ребенок мог унаследовать любую из хромосом такого родителя, то для данной семьи не удастся установить сцепление с определенным локусом. Анализ такого заболевания позволяет утверждать, что картина похожа на случай, когда в выборке имеется большая доля семей с негенетической природой заболевания.
Однако проблема гомозиготности родителей становится значительной только при достаточно высокой частоте соответствующего аллеля по данному локусу. По существу, успешно могут быть картированы только те компонентные локусы, в которых аллели, обусловливающие заболевание, встречаются с низкой частотой.
Иногда следует учитывать параметры, минимизирующие эффект гомозиготности родителей. К примеру, изучение семей с очень большой долей пораженных сибсов может быть нежелательным: в такой семье более вероятно, что один или оба родителя гомозиготны по одному или более компонентным локусам.
Кроме проблемы гомозиготности родителей существует еще одно осложнение при картировании генетического взаимодействия: здоровые дети значительно затрудняют любую попытку картировать отдельный компонентный локус. Если ребенок и наследует по какому-то локусу аллель, ответственный за заболевание, он может не унаследовать саму болезнь, если не унаследует всех необходимых для данного заболевания аллелей по другим локусам. Таким образом, как было отмечено выше, генотипы здоровых детей не могут рассматриваться как свидетельство против сцепления с возможным локусом; полагаться стоит только на генотипы больных детей.
Если предположить, что больные дети являются следствием исключительно генетических причин и что частота аллелей невелика, то анализ сцепления становится относительно простым.
1. Для рецессивного компонентного локуса картирование происходит как и в моногенном случае: признак будет сегрегировать совместно с каждым из рецессивных компонентных локусов; требуется такое же количество семей с заданным числом больных индивидов.
2. Для доминантного компонентного локуса единственное отличие от моногенного случая заключается в том, что нельзя сказать, какой из двух родителей привносит аллель, ответственный за болезнь. Вследствие этого необходимо количество семей большее, чем для случая простого моногенного наследования.
7. Полигенное наследование
Известно, что наследование некоторых признаков характеризуется такими генетическими феноменами, как гетерогенность, неполная пенетрантность или интегрирующее взаимодействие. Наиболее сложное наследование – полигенное, при котором аллели нескольких разных локусов взаимодействуют друг с другом по принципу аддитивности, обусловливая таким образом риск проявления признака или заболевания. Каждый добавочный «плохой» аллель увеличивает предрасположенность индивида, но ни один из локусов не является существенным для этиологии данного заболевания. Поэтому в данном случае невозможно по фенотипу определить генотип. Расчеты показывают, что картирование полигенных заболеваний в общей популяции людей бесперспективно. Тем не менее, для поиска полигенных факторов при скрещивании линий животных, отличающихся по физиологическим признакам, были разработаны методы, использующие весь потенциал полной карты ПДРФ-маркеров. Подобные исследования могут выявить специфические локусы, которые в дальнейшем следует изучать более прямыми методами у человека.
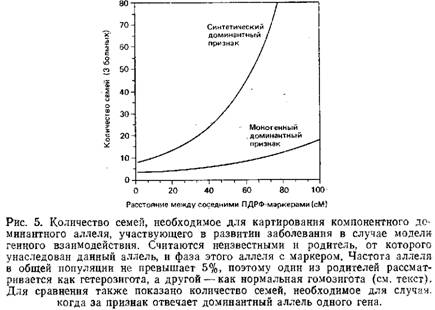
8. Картирование редких рецессивных признаков
В случае многих заболеваний трудно подобрать достаточное количество семей с несколькими больными индивидами для проведения традиционного анализа сцепления. Многие рецессивные нарушения, имеющие медицинскую или биологическую значимость, очень редки и возникают случайно у отдельных индивидов или в малых группах. Даже для распространенных заболеваний подбор семей с несколькими больными может быть сложной задачей, если болезнь приводит к гибели в раннем возрасте.
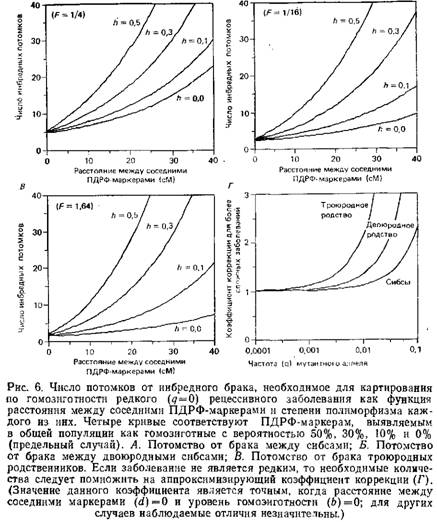
Недавно для картирования редких рецессивных заболеваний был описан эффективный подход, названный картированием по гомозиготности. При этом используется ДНК больных детей от близкородственных браков. В 1902 году Гэррод заметил, что значительную часть его больных алкаптонурией составляли дети от браков между родственниками. Почти сразу же Бэтсон предложил объяснение, основанное на законах Менделя и состоявшее в том, что близкородственные браки предоставляют наилучшую возможность для рецессивного аллеля перейти в гомозиготное состояние. Действительно, чем реже болезнь, тем большей будет доля инбредных браков среди родителей больных детей: если частота аллеля, ответственного за данное заболевание в данной популяции, есть q, то вероятность его гомозиготности в целой популяции пропорциональна q2, но пропорциональна q в инбредной популяции. Значительная область хромосомы, фланкирующая предполагаемый локус заболевания, также переходит в гомозиготное состояние «по происхождению». Для ребенка от брака двоюродных родственников среднестатистический размер этой области гомозиготности «по происхождению» достигает приблизительно 28 см. Отсюда следует стратегия поиска локуса, ответственного за болезнь: необходимо найти область, неизменно гомозиготную «по происхождению», у больных детей от близкородственного брака.
Если бы существовала возможность достоверного выявления гомозиготности «по происхождению», можно было бы установить сцепление с тем или иным заболеванием на основе данных всего лишь по трем больным потомкам от брака двоюродных сибсов. Это возможно, поскольку вероятность того, что искомый участок будет гомозиготным «по происхождению» у данного ребенка, равна 1, а вероятность того, что случайный участок будет гомозиготен «по происхождению», равна 1/16 – коэффициенту инбридинга при браке двоюродных родственников. Поэтому отношение шансов за правильность выбора фрагмента составит 16:1. Если установлено, что искомый участок гомозиготен «по происхождению» у трех независимых детей от данного инбредного брака, отношение вероятностей составит 163, или 4096:1, что превышает общепринятый порог правдоподобия 1000:1.
Конечно, невозможно с высокой точностью распознавать гомозиготность «по происхождению». Однако можно использовать плотную карту сцепления на основе ПДРФ для поиска района, в котором многие прилегающие ПДРФ-маркеры становятся гомозиготными. Эффективность этого метода будет зависеть от плотности используемых маркеров рестрикции и уровня их полиморфизма. Рис. 6 показывает количество потомков от брака двоюродных и троюродных сибсов, необходимое для картирования гомогенного рецессивного заболевания. Если использовать карту ПДРФ с полиморфными локусами на каждые 5 см, для обнаружения сцепления понадобится менее 20 инбредных детей в таких браках. Для относительно редких рецессивных заболеваний метод гомозиготного картирования может оказаться лучшим.
Хотя такая точная карта сцепления на основе ПДРФ-маркеров пока недоступна, при существующих темпах прогресса ее удастся получить в ближайшие несколько лет. Поэтому сбор образцов ДНК больных детей от браков двоюродных и троюродных родственников представляется уже целесообразным. Генетики, интересующиеся картированием сцепления, должны проявить особый интерес к тем странам, где близкородственные браки все еще распространены. В качестве примера: одна треть всех браков в индийском штате Андра-Прадеш заключается между дядей и племянницей.
Заключение
Использование ПДРФ-маркеров в генетике человека революционизировало эту отрасль знаний. Стало возможным картировать и в конечном счете клонировать гены, ответственные за признаки и болезни человека, почти таким же способом, как это делается для экспериментальных животных. Единственное остающееся ограничение заключается в том, что такие признаки требуют особого внимания, так как нет возможности применять к ним традиционные экспериментальные подходы.
Используя весь потенциал полной карты сцепления ПДРФ-маркеров человеческого генома, можно разработать альтернативные подходы, позволяющие преодолеть эти генетические затруднения. При настоящих темпах картирования ПДРФ надежда получить такую карту в ближайшие два года кажется оправданной. В будущем при планировании анализа сцеплений исследователи, рассматривая возможные пути преодоления генетических сложностей, могут рассчитывать на доступность карты ПДРФ-маркеров. Некоторые из таких подходов были описаны выше.
Как, должно быть, уже заметил читатель, «оптимальный» подход к изучению сцепления зависит в некоторой степени от точного знания природы генетических трудностей, которые предстоит преодолеть. Однако не часто такие подробности можно с точностью заранее определить. Следует начинать изучение сцепления с выявления на основе имеющихся данных спектра возможных осложнений. Далее следует определить доступный популяционный материал и арсенал медицинских методов, который можно использовать для упрощения задачи. Затем, основываясь на допущениях, принятых для различных типов наследования, следует вычислить количество различных семей, необходимое для картирования признака. В конечном счете проводится подбор семей, готовятся препараты ДНК. которые анализируют по большому количеству ПДРФ. Если предположения о генетической этиологии заболевания верны, то вероятность обнаружения сцепления велика. Если же признак в действительности более сложен, чем это предполагалось, сцепление не будет обнаружено. Отрицательный ответ при поиске по всему геному докажет по крайней мере, что заболевание более сложно, чем исходно предполагалось.
Таким образом, используя весь потенциал карты сцепления человеческого генома, построенной на основе ПДРФ, можно расширить область изучения наследственности человека, выйдя за рамки набора признаков, наследуемых исключительно по законам Менделя. В ходе подобных исследований может быть разрешен широкий круг медицинских вопросов, а также достигнут общий прогресс в исследованиях в области биологии млекопитающих.
Похожие работы
... , в нашем геноме есть масса повторяющихся участков. Действительно, очень интересно, почему человек - "венец эволюции" имеет огромную долю "неработающего" генома. Рис. 2. Примерное распределение генов человека по их функциям. 1 – производство клеточных материалов; 2 – производство энергии и ее использование; 3 – коммуникации внутри и вне клеток; 4 – защита клеток от инфекций и повреждений; 5 – ...
... только те страны и компании, которые в состоянии выложить за это значительные деньги. Бедные же страны, например африканские, могут оказаться отрезанными от достижений прогресса в геномике.Изучая проект «Геном человека» учёныё столкнулись с величайшим открытием века. Коротко об этом: Электромагнитный апокалипсис. Как это ни странно звучит, но в последние десятилетия в науке открылись такие ранее ...
... отклонениям в развитии организма. Например, цитогеническим методом установлены причины болезни Дауна у человека. Эту болезнь вызывает наличие лишней хромосомы в одной из хромосомных пар. В генетике человека нередко применяется генеалогический метод - изучение родословных. Он позволяет выявить доминированность или рецессивность гена, сцепленность генов между собой и с полом. В клетках человека ...
... придется смириться с определенным числом химически индуцированных мутаций, поскольку общество не может отказаться от тех преимуществ, которые дают ему достижения современной химии. В будущем человечеству придется столкнуться с увеличением частоты спонтанных мутаций. Оно приведет к соответствующему увеличению численных и структурных хромосомных аберраций и наследственных заболеваний, ...




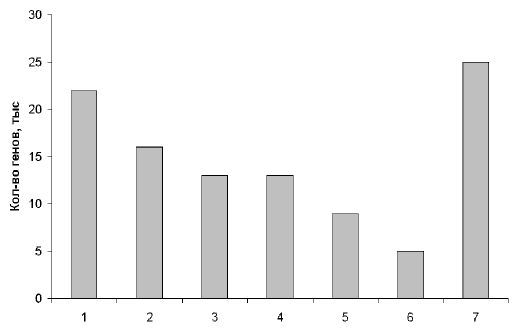
0 комментариев