Навигация
Осложнения: неполная пенетрантность и ошибки клинической диагностики
4. Осложнения: неполная пенетрантность и ошибки клинической диагностики
Генетический признак, для проявления которого необходимы дополнительные факторы, проявляет неполную пенетрантность. Эти факторы могут включать в себя условия окружающей среды, генетическое предрасположение, а также случайность. Простой пример – ретинобластома, при которой у индивидов, наследующих одну дефектную копию рецессивного онкогена, развивается рак, если вторая копия инактивирована событиями в соматических клетках; это случайное событие встречается достаточно часто, поэтому пенетрантность высока. В семьях с наследственными формами болезни Альцгеймера заболевание может не проявить полную пенетрантность попросту из-за того, что некоторые пораженные погибнут по другим причинам, так и не проявив симптомов. Синдром Вернике – Корсакова вызван, по-видимому, мутацией, приводящей к более слабому по сравнению с нормой присоединению транскетолазой тиаминпирофосфата, однако клинический фенотип проявляется только у больных, предпочитающих диету, обедненную тиамином; таким образом, степень пенетрантности может широко варьировать в зависимости от условий окружающей среды и точности определения фенотипа. Многие заболевания, такие, как наследственные формы маниакально-депрессивного психоза, проявляют неполную пенетрантность по неизвестным причинам.
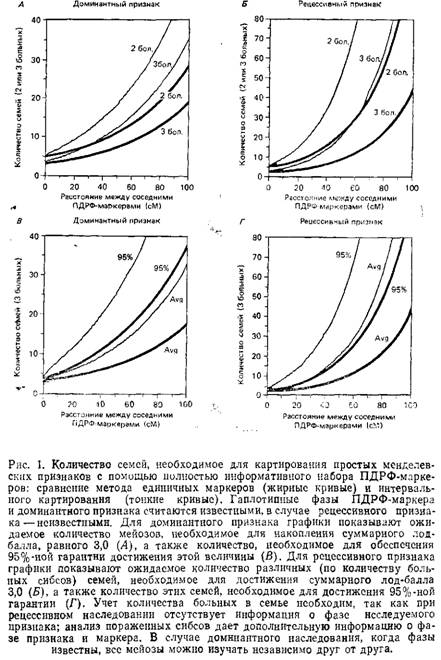
В случае болезни, наследуемой как доминантный признак с полной пенетрантностью, здоровые дети от брака с одним больным родителем так же информативны, как и больные дети: в обоих случаях мы точно знаем, какой аллель локуса, ответственного за заболевание, был унаследован каждым из них. Однако, когда пенетрантность неполная, генотип здорового потомка от больного родителя всегда неоднозначен. Неудивительно, что и анализ наследуемых ими маркеров мало что может дать в этом отношении, поскольку мы не знаем точно, унаследовали они мутантный аллель или нет. Рис. 2 показывает, как быстро уменьшается величина суммарного лод-балла с уменьшением степени пенетрантности.
Проблема неопределенности генотипа здорового индивида возникает и в случае рецессивного признака при полной пенетрантности: существуют три возможных генотипа для группы здоровых сибсов, но только один – для группы больных. Для тесно сцепленного маркера отношение шансов будет 1: в случае здоровых сибсов и 1: в случае больных, что делает вклад в суммарный лод-балл от больных членов в 5 раз меньшим, чем у здоровых. Неполная пенетрантность только усложняет ситуацию.
Оценивая информативность семьи для анализа сцепления, необходимо обратить внимание на количество мейозов, порождающих появление больных индивидов. Сбор данных по здоровым сибсам не приведет к ошибке, но необходимо ясно представлять, что польза от этих данных для идентификации локуса, ответственного за болезнь, относительно невелика, кроме случаев доминантности с полной пенетрантностью.
Следует учесть, что неполная пенетрантность ^заметно осложняет анализ сцепления. Если в проверяемую на сцепление модель не заложена соответствующая степень неполноты пенетрантности, тогда истинное сцепление может быть полностью просмотрено: здоровые индивиды окажутся рекомбинантами. Чтобы исключить сцепление данной болезни с каким-либо районом, необходимо провести специальный анализ, принимая степень пенетрантности очень низкой. Величина суммарного лод-балла при этом будет отражать информацию, полученную от больных индивидов.
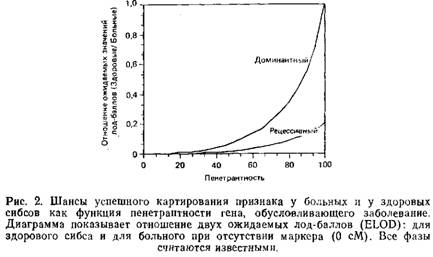
Обратным по отношению к проблеме неполной пенетрантности является вопрос о возможности ошибочной диагностики болезни у здоровых индивидов. В то время как неполная пенетрантность определяет неоднозначность генотипа здорового индивида и тем самым снижает его ценность в анализе сцепления, возможность неправильного диагноза означает, что и генотипы больных индивидов также должны рассматриваться как неоднозначные. Ошибочный диагноз маловероятен для таких явных заболеваний, как муковисцидоз, но представляет серьезную проблему при анализе психических нарушений. В диагностические критерии для этих заболеваний включено огромное количество поведенческих реакций, а наличие других больных в этой семье зачастую рассматривается как подтверждение диагноза. Используя рис. 3, можно оценить влияние данного уровня ошибок диагностики на анализ сцепления. Так как неправильная диагностика может серьезно отразиться на анализе сцепления, лучший выход из положения – приписывать всякому индивиду, диагноз которого сомнителен, «неизвестный фенотип». Только после обнаружения сцепления можно вернуться к таким индивидам и выяснить, унаследовали ли они генотип больного. Только таким путем можно узнать, являются ли неоднозначные симптомы проявлением исследуемого заболевания.
5. Осложнения: генетическая гетерогенность и фенокопии
Самым серьезным препятствием при изучении сцепления является генетическая гетерогенность, связанная с тем фактом, что мутации в разных локусах приводят к одному фенотипу. Классические примеры генетической гетерогенности для низших организмов – прерывание автономного биохимического пути на любой из его стадий и потеря или нарушение гетеромультимерного белкового комплекса вследствие мутаций в структурном гене любой из его субъединиц. Несложно представить и другие возможные причины гетерогенности. Ими могут быть мутации регуляторных генов или посттрансляционные модификации. Хотя у низших организмов генетическая гетерогенность фенотипов является правилом, это не приводит к серьезным осложнениям, поскольку генетик всегда может поставить комплементационное скрещивание для проверки аллельности мутаций.
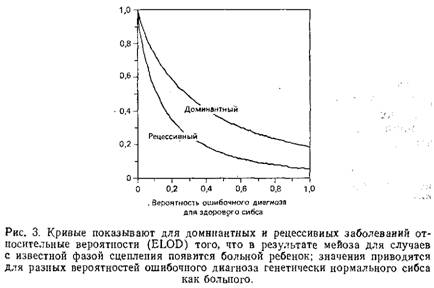
Феномен генетической гетерогенности у человека изучен в меньшей степени, однако нет оснований полагать, что в данном случае он более редок. К примеру, выяснилось, что наследственная метгемоглобинемия, которая ранее рассматривалась в клиническом отношении как однородная, может быть вызвана мутациями как альфа-, так и бета-цепей гемоглобина или даже мутациями NADH-дегидрогеназы. Эллиптоцитоз и болезнь Шарко-Мари-Туса оказались гетерогенными, поскольку в обоих случаях тесное сцепление, наблюдаемое в одних больших родословных, полностью отсутствовало в других. Сходная картина обнаружена и при изучении наследования маниакально-депрессивного психоза в большой родословной религиозной общины амишей, в которой было выявлено сцепление этого заболевания с одним из сегментов хромосомы Пр. В других больших родословных подобное сцепление не было обнаружено. По-видимому, пигментная ксеродерма и синдром Луи-Бар генетически гетерогенны, поскольку опыты in vitro на клеточных экстрактах выявили соответственно девять и пять групп комплементации. Некоторые браки дают возможность исследовать комплементацию и у человека. Так, семьи, в которых оба родителя страдают альбинизмом, а все их дети – здоровые, демонстрируют генетическую гетерогенность альбинизма, на что ранее указывали фенотипические различия и популяционная генетика. Сходные данные предполагают гетерогенную природу врожденной глухоты.
Гетерогенность – это настоящий кошмар для генетика, поскольку в разных семьях можно найти свидетельства как в пользу сцепления, так и против него. Даже небольшая степень гетерогенности может сказаться на стандартном лод-балле, приводя к отрицательным значениям, даже если маркер тесно сцеплен с одним из локусов, контролирующих признак.
Возможное разрешение затруднений, вызванных гетерогенностью, состоит в следующем.
1. Дифференциация клинических форм заболевания. Наилучший способ преодолеть генетическую гетерогенность – это выявить клинический признак, по которому различные генетические формы четко отличаются: исследование одного гетерогенного нарушения сводится тогда к изучению двух или более гомогенных нарушений. Так, к примеру, клинические фенотипы были использованы для выявления двух форм нейрофиброматоза, которые по данным недавних исследований картируются в различных локусах.
К сожалению, пока нет единого правила, позволяющего безошибочно дифференцировать различные формы генетического заболевания. Клиническая картина заболевания может значительно варьировать вследствие как минимум трех причин:
а) единичная мутация в единственном локусе может экспрессироваться различным образом под влиянием несцепленного генетического локуса, выполняющего роль модификатора окружающей среды или в силу простой случайности;
б) различные мутации в одном локусе могут нарушить одну и ту же биохимическую функцию, но по-разному или с разной степенью, как это имеет место в случае мышечной дистрофии Бекера, которая вызвана менее тяжелыми по своему проявлению аллелями гена мышечной дистрофии Дюшенна;
в) заболевание может быть вызвано мутациями в нескольких разных локусах.
Такие явления носят соответственно названия: эффект фона, аллельная гетерогенность, генетическая гетерогенность.
Другими словами, болезнь может быть клинически гетерогенна, даже если она не является гетерогенной генетически, обратное утверждение тоже верно. Для того чтобы рассматривать клинические различия как полезный генетический инструмент, необходимо показать сначала, что все члены данной семьи попадают в один фенотипический подкласс. К примеру, естественным кандидатом для анализа на дифференциацию генетической картины психического нарушения был бы признак восприимчивости к определенному лекарству. К сожалению, лишь немногие исследователи изучали склонность больных индивидов из одной семьи сходным образом реагировать на лекарства.
Дифференциация фенотипов – ключевой момент в медицинской генетике. Однако следует также полагаться на интуицию, ведь нельзя с уверенностью утверждать, что картина заболевания полностью ясна.
2. Изучение отдельной большой родословной. Другой подход, позволяющий избежать осложнений, вызванных генетической гетерогенностью, – это работа с отдельной родословной, достаточно большой для проведения анализа сцепления. К примеру, Гузелла проанализировал одну обширную родословную из Венесуэлы, в которой сегрегировала хорея Гентингтона. Хотя дальнейшие исследования сцепления показали, что люди, страдающие этой болезнью, составляют генетически гомогенную группу, этот факт все же нельзя было заранее предсказать. При исследовании большой родословной в религиозной общине амишей Эгланд продемонстрировал расщепление по наследуемой форме I маниакально-депрессивного психоза. Кроме того, обнаружено сцепление с ПДРФ-маркером на хромосоме Пр. Анализ нескольких других больших родословных не выявил сцепления с этим районом и доказал таким образом наличие гетерогенности.
В подходе, использующем большие родословные, существуют некоторые недостатки:
а) для большинства доминантных и почти для всех рецессивных заболеваний просто невозможно найти достаточно большой родословной;
б) попытка «расширить» родословную путем выявления как можно большего количества больных может на самом деле привнести гетерогенность в случаях широко распространенных мультификаториальных заболеваний, таких, как маниакально-депрессивный психоз, ишемическая болезнь сердца и др. При сборке таких родословных из большой смешанной популяции, каковой является население США, возникает вероятность того, что в разных частях одной и той же родословной будут сегрегировать аллели или локусы, ответственные за разные заболевания. С позиций анализа сцепления такая внутрисемейная гетерогенность еще хуже, чем гетерогенность межсемейная;
в) даже если подход, основанный на анализе больших родословных, увенчается успехом, сделанный вывод нельзя переносить на общую популяцию.
Чтобы выяснить, имеют ли полученные данные общее значение, необходимы дальнейшие интенсивные исследования на многих других семьях. Действительно, сцепление между маниакально-депрессивным психозом и маркерами на хромосоме lip, выявленное в большой родословной амишей, надо доказать на примере других родословных. Предположительно это может быть очень редкая форма МДП. Несмотря на эти ограничения, подход с использованием больших родословных может быть достаточно полезным, особенно для относительно редких заболеваний.
3. Изучение отдельного географического района. Аналогичный подход, позволяющий избежать эффекта генетической гетерогенности, заключается в проведении исследований в изолированной общине. Заболевания, которые в смешанной популяции, такой, как США, являются гетерогенными, в изолированной группе скорее всего будут обусловлены уникальной мутацией.
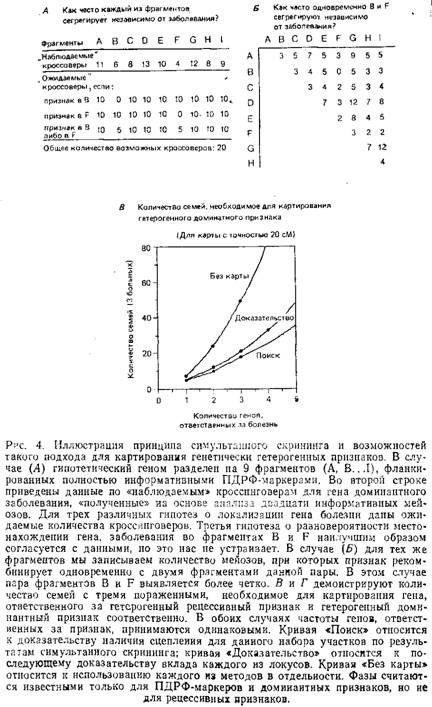
4. Симультанный скрининг генома с использованием малых семей. Доступность полной карты сцепления ПДРФ человеческого генома делает возможным выявить сцепление, даже если в изучаемой популяции сегрегирует более чем один локус. Этот недавно разработанный метод, известный как симультанный скрининг, подводит к естественному обобщению стандартного метода картирования сцепления.
После приготовления препаратов ДНК отобранных семей проводится анализ ПДРФ-маркеров, охватывающих весь геном. Если для всех семей один и тот же фрагмент генома окажется тесно сцепленным с исследуемым заболеванием, картирование на этом будет закончено. Если сцепление не будет обнаружено ни с одним из фрагментов генома, следует проверять все пары фрагментов с целью найти такую их пару А и В, для которой в каждой семье наблюдается тесное сцепление признака либо с фрагментом А, либо с фрагментом В. Если болезнь связана с мутациями в одном из двух локусов, то правильным образом выбранная пара будет обладать указанным свойством.
Для вычисления лод-баллов по любой из пар фрагментов А и В необходимо подсчитать: 1) вероятность появления заболевания для случая, когда оно обусловлено мутациями как по локусу из фрагмента А, так и по локусу из фрагмента В и 2) вероятность появления заболевания в случае, когда оба фрагмента А и В не сцеплены с заболеванием. Смысл состоит в том, что легче выявить пару участков, по которым идет расщепление во всех семьях, чем выделить единичный участок, объясняющий сегрегацию только в половине семей.
Важная проблема – это выбор удовлетворительного порога для принятия наличия сцепления. Так как рассматривается много различных гипотез, вероятность того, что a priori каждая данная гипотеза верна, уменьшается, поэтому обычный порог 3,0 должен быть увеличен в случаях, когда анализируют одновременно два интервала. Ландер и Ботштейн рассмотрели этот математический вопрос и подсчитали количество семей, необходимое для выявления сцепления с доминантным или рецессивным гетерогенным признаком для семей, различных по величине. Основная идея сделанного ими вывода: необходимо отбирать семьи с количеством больных в одном поколении не меньше трех, а в случае с доминантным признаком также и с одним больным родителем.
Метод симультанного скрининга может быть использован не только для поиска локусов, как в приведенном выше примере, но и для проверки ранее установленных другими методами локусов-кандидатов, с той лишь разницей, что для группы порог требуется меньший, чем для начального выявления единичного локуса. Для некоторых гетерогенных заболеваний сцепление с различными локусэми может быть первоначально установлено традиционным анализом на сцепление, проводимым в больших родословных. Чтобы решить вопрос о достаточности только этих локусов для объяснения ситуации с данным заболеванием, необходимо, используя метод симультанного скрининга, исследовать малые семьи для достижения суммарного лод-балла, равного 3,0.
Заметим, что, хотя генетическая гетерогенность может свести на нет усилия традиционного анализа сцепления, она не выявляется даже сегрегационным анализом: сколько бы разных локусов ни участвовало в проявлении рецессивного признака, в каждой семье ожидаемое менделевское расщепление равно 3:1.
С проблемой гетерогенности тесно связано явление фенокопий. О фенокопии говорят, когда негенетическая причина сказывается на проявлении фенотипа, характерного для наследственного заболевания. К примеру, гомозиготность по мутантному аллелю гена i-антитрипсина часто вызывает легочную эмфизему, но более частой причиной такого фенотипа в общей популяции является курение.
Фенокопии сказываются на анализе сцепления таким же образом, как и гетерогенность: наряду с семьями, в которых выявляется сцепление с маркером, обнаруживаются семьи, в которых расщепление затрагивает разные локусы. В случае независимости возникновения фенокопии в общей популяции можно повысить генетическую информативность семей, введя требование о большем количестве содержащихся в них больных индивидов. Так, генетическая этиология более вероятна для семьи, где пять близких родственников болеют раком молочной железы, нежели для семьи, где больных всего двое. Однако этот аргумент теряет значение, если фенокопии появляются в семейных кластерах, к примеру, вследствие сходных условий проживания. В этом случае необходимо попытаться собрать однородную выборку семей, в которых сегрегирует генетическая ферма этого заболевания, и анализировать ее на основе стратегии, описанной выше для генетической гетерогенности. Если предполагаются и генетическая гетерогенность, и фенокопии, симультанный скрининг может быть модифицирован с учетом коррекции на долю «несцепленных» семей.
В любом случае слишком большая доля фенокопии в выборке значительно затруднит всякую попытку найти сцепление.
Похожие работы
... , в нашем геноме есть масса повторяющихся участков. Действительно, очень интересно, почему человек - "венец эволюции" имеет огромную долю "неработающего" генома. Рис. 2. Примерное распределение генов человека по их функциям. 1 – производство клеточных материалов; 2 – производство энергии и ее использование; 3 – коммуникации внутри и вне клеток; 4 – защита клеток от инфекций и повреждений; 5 – ...
... только те страны и компании, которые в состоянии выложить за это значительные деньги. Бедные же страны, например африканские, могут оказаться отрезанными от достижений прогресса в геномике.Изучая проект «Геном человека» учёныё столкнулись с величайшим открытием века. Коротко об этом: Электромагнитный апокалипсис. Как это ни странно звучит, но в последние десятилетия в науке открылись такие ранее ...
... отклонениям в развитии организма. Например, цитогеническим методом установлены причины болезни Дауна у человека. Эту болезнь вызывает наличие лишней хромосомы в одной из хромосомных пар. В генетике человека нередко применяется генеалогический метод - изучение родословных. Он позволяет выявить доминированность или рецессивность гена, сцепленность генов между собой и с полом. В клетках человека ...
... придется смириться с определенным числом химически индуцированных мутаций, поскольку общество не может отказаться от тех преимуществ, которые дают ему достижения современной химии. В будущем человечеству придется столкнуться с увеличением частоты спонтанных мутаций. Оно приведет к соответствующему увеличению численных и структурных хромосомных аберраций и наследственных заболеваний, ...




0 комментариев