Навигация
Получение тетрахлорэтилена
1.2 Получение тетрахлорэтилена
Тетрахлорэтилен образуется при высокотемпературном хлорировании дихлорэтана или хлорорганических отходов С3:
![]() (1.8)
(1.8)
Оксихлорирование полихлоридов С2-С3 также приводит к получению и тетрахлорэтиленов:
![]() (1.9)
(1.9)
Современное производство хлорорганических растворителей, таких как тетрахлорэтилен, базируется на этилене, пропан-пропиленовой фракции и, в меньшей степени, этане. Методы, основанные на использовании ацетилена, в значительной мере устарели, однако до настоящего времени они осуществляются в промышленности. Совмещение процессов гидро- и дегидрохлорирования позволяет создать сбалансированную по хлороводороду технологическую схему, поэтому при наличии дешевого ацетилена данный способ может конкурировать с другими. Существенную роль в структуре сырьевой базы играют хлорорганические отходы производства винилхлорида, дихлорэтана, аллилхлорида, эпихлоргидрина и ряда других хлорорганических производств.
В целом процесс получения тетрахлорэтилена включает стадии высокотемпературного хлорирования (хлоролиз), дегидрохлорирования соответствующих хлорэтанов. Поскольку на каждой стадии образуется хлороводород, для создания сбалансированной по НС1 схемы последний целесообразно комбинировать со стадией гидрохлорирования или оксихлорирования.
Высокотемпературному хлорированию обычно подвергаются хлорорганические отходы C1-С4. Процесс протекает при 500-650°С в полом реакторе или в реакторе с псевдоожиженным слоем катализатора.
Перхлорэтилен получают также одновременно с четыреххлористым углеродом хлоролизом хлорорганических отходов С3, например отходов производства аллилхлорида. Процесс хлоролиза осуществляется при 500°С в избытке хлора. Основными недостатками процесса хлоролиза являются образование побочных хлористого водорода, гексахлорбензола и сажи. При хлоролизе протекает реакция:
![]() , (1.10)
, (1.10)
которая позволяет регулировать отношение между четыреххлористым углеродом и тетрахлорэтиленом.
Процессы получения тетрахлорэтилена на базе этилена осуществляются двумя способами. Первый способ - двухстадийный, на первой стадии которого прямым хлорированием этилена при температуре 136°С получают смесь тетра- и пентахлорэтанов, на второй - их подвергают высокотемпературному пиролизу с образованием тетрахлорэтилена. Расход тепловой энергии при термическом дегидрохлорировании сопоставим с расходом тепловой энергии дегидрохлорирования по известковому методу.
Стадия дегидрохлорирования хлорэтанов осуществляется в присутствии инициатора или катализатора. Ряд авторов, с целью создания сбалансированной по хлороводороду схемы, предлагают проводить процесс дегидрохлорирования в присутствии кислорода, условно называя этот процесс «окислительным дегидрированием» /7/:
![]() (1.11)
(1.11)
Реакция протекает в присутствии традиционного катализатора СuС12×КС1/носитель или МnО2 Предлагаемый способ дегидрохлорирования является весьма перспективным. Недостатком способа получения тетрахлорэтилена на основе этилена является потеря хлора в виде неутилизируемого хлороводорода. Поэтому более целесообразно проводить двухстадийный процесс следующим образом: на первой стадии методом окислительного хлорирования этилена при 200-230°С в кипящем или стационарном слое катализатора получать 1,2-дихлорэтан, а затем на второй стадии подвергнуть его высокотемпературному хлорированию. Таким образом удается утилизировать часть хлороводорода. Большой интерес представляет другой способ получения тетрахлорэтилена - одностадийное окислительное хлорирование углеводородов С2. Для производства тетрахлорэтилена часто применяют не сам этилен, а его хлорпроизводные, например 1,2-дихлорэтан. По разработке фирмы «PPG, Industries Inc.» /7/ процесс окислительного хлорирования 1,2-дихлорэтана проводят в трубчатом реакторе с псевдоожиженным слоем катализатора. Температура процесса поддерживается за счет кипящей в межтрубном пространстве жидкости. Тепло реакции используется для получения пара, необходимого для самого процесса.
В настоящее время ведутся интенсивные работы по повышению селективности данного процесса. Введение хлоридов редкоземельных элементов позволяет снизить выход продуктов глубокого окисления в 3 раза. Для повышения селективности процесса окислительного хлорирования 1,2-дихлорэтана применяют непрерывную подачу в реакционную зону 1,1,2-трихлорэтана. Образованию продуктов глубокого окисления способствуют местные перегревы, для устранения которых в работе процесс проводят в присутствии катализатора, содержащего хлорид меди с добавлением фосфата щелочного металла. В работах снижение выхода продуктов глубокого окисления достигается секционированной подачей кислорода, благодаря чему по мере прохождения кислорода по слою катализатора в реакцию вступают все более хлорированные углеводороды. Выявлению причин образования продуктов глубокого окисления в научно-технической литературе посвящено лишь небольшое число публикаций.
Окислительному хлорированию с целью получения четырех-хлористого углерода и тетрахлорэтилена подвергается смесь углеводородов C1-C4, хлоруглеводородов С3 и хлоруглеводородов С4-С6. В отличие от хлоролиза хлоруглеводородов С3, приводящего к образованию эквимольной смеси СС14 и C2HCl3, состав продуктов окислительного хлорирования существенно зависит от используемого катализатора.
Перечисленные способы окислительного хлорирования основаны на использовании в качестве хлорирующего агента смеси HCl-газа и кислорода. Ввиду неполной конверсии НС1, а также его образования при окислении и дегидрохлорировании хлоруглеводородов этот газ содержится в конечных продуктах, что создает проблему утилизации абгазного НС1 или загрязненной хлоруглеводородами HCl-кислоты. Вовлечение этой кислоты в процесс окислительного хлорирования несомненно представляет практический интерес, поскольку до настоящего времени она не находит сбыта и загрязняет окружающую среду. В процессе окислительного хлорирования с получением три- и тетрахлорэтилена могут быть использованы хлоруглеводороды C1-С3. При использовании 1,2-дихлорэтана катализатором процесса является цеолит с содержанием 4% (мас.) Сu2+ и 2,5% К+. Процесс протекает при температуре 400 °С, мольном отношении реагентов C2H4Cl2:O2:HCl:H2O = = 1:1,4:1,2:5,6 и времени контакта 10-25 с. Процесс характеризуется ровным температурным профилем по длине реактора и достаточно высокой селективностью.
Оксихлорированне полихлоридов С3 с образованием четыреххлористого углерода и тетрахлорэтилена сопровождается процессами глубокого окисления, а распределение продуктов, а именно хлорметанов и хлорэтиленов, зависит от используемой каталитической системы. Перераспределение между хлорметанами и хлорэтиленами, очевидно, связано с возможностью превращения хлорпроизводных C1 в хлорпроизводные С2 или их различной реакционной способностью в реакции окисления. Изучался процесс окисления в железной, цинковой и медной трубках хлорпроизводных углеводородов, реакционная способность которых в реакции окисления оценивалась по количеству образовавшегося фосгена; установлено, что наибольшей способностью превращаться в фосген обладает четыреххлористый углерод: СС14>СНС13>С2НС13>С2С14.
Таким образом, основным недостатком процессов окислительного хлорирования хлорпроизводных углеводородов является образование продуктов окисления и высокая экзотермичность процесса, что делает этот процесс труднорегулируемым. Наибольшее распространение получили трубчатые реакторы со съемом тепла циркулирующим в межтрубном пространстве теплоносителем. Поэтому для обеспечения хорошей теплопроводности процессов и снижения износа катализатора выбор носителя имеет существенное значение. Для увеличения срока службы катализатора и поддержания его первоначальной активности предлагаются различные меры, например периодическая замена части загрузки катализатора, размещение по высоте реактора катализатора с различным содержанием активной массы, постепенное повышение температуры реакции; регулирование суммарного теплового эффекта реакции путем изменения состава и соотношения в подаче сырья, состоящего из смеси 1,2-дихлорэтана и других хлоруглеводородов С2 с различной степенью замещения хлором. Добавление полихлорэтанов к дихлорэтану позволяет вести процесс без избыточного выделения тепла, что устраняет местные перегревы и увеличивает срок службы катализатора.
Однако из-за высокой экзотермичности процесса окислительного хлорирования с участием медьсодержащего солевого трегерного катализатора возникают трудности, связанные со съемом тепла реакции, недостаточностью контакта с сырьем, что отрицательно сказывается на полноте хлорирования и на селективности процесса. Для улучшения теплопередачи, увеличения выхода и повышения селективности, сохранения активности катализатора фирмы «Du Pont» и «Lummus» разработали процессы оксихлорирования хлорпроизводных углеводородов Сг с при менением катализатора в виде расплава. В состав катализатора фирмы «Lummus» входят хлориды и оксиды Mn, Fe, Си, Со, Сг, а также хлориды К и Li. Указанный катализатор позволяет снизить температуру начала плавления до 260 °С. Процесс протекает при температуре 359-650°С, давлении 0,1-2 МПа и времени контакта 1-60 с. Описан процесс, в котором наряду с тетрахлорэтиленом образуется четыреххлористый углерод. Исходная реакционная смесь состоит из четыреххлористого углерода, хлоруглеводорода, хлороводорода и кислорода. Катализаторы состоят из хлоридов меди, щелочного и щелочноземельного металла, а также хлорида Fe, Zn, Mn, Cr, Ni, Pd и хлорида редкоземельного металла. Применение ка тализатора в виде расплава связано с повышенными энергозатратами и сильной коррозией оборудования.
Наиболее перспективным способом получения три- и тетра-хлорэтиленов в настоящее время является окислительное хлорирование хлорорганических отходов, позволяющее улучшить баланс процессов хлорирования по хлористому водороду.
Технологическая схема (рис. 1.2) процесса включает окислительное хлорирование полихлоридов С3, закалку реакционных газов, конденсацию и стабилизацию продуктов реакции /7/.
Окислительное хлорирование полихлоридов С3 осуществляется в трубчатом реакторе со стационарным слоем нанесенного медьсодержащего катализатора. Тепло реакции снимается циркулирующим в межтрубном пространстве теплоносителем, в качестве которого используется дифенильная смесь. Полихлориды С3, представляющие собой отходы производства глицерина и пропиленоксида, и НС1 (кислота) после предварительного нагрева в испарителях 2 и 1 соответственно перед поступлением в реактор-оксихлоратор 3 смешиваются. Соотношение исходных реагентов определяет состав конечных продуктов. Оксихлорирование осуществляется при температуре 400°С и времени контакта 5-8 с. Контактный газ после предварительного охлаждения в закалочном сопле 4 до 300°С за счет впрыска HCl-кислоты направляется в низ закалочной колонны 5. В закалочной колонне происходит охлаждение реакционных газов до 100°С, конденсация основной части хлоруглеродов и воды, отгонка хлоруглеводородов в виде азеотропной смеси с водой, а также абсорбция хлороводорода с получением 20%-й HCl-кислоты в кубе колонны. Хлоруглеводороды и HCl-кислота из куба закалочной колонны направляются в разделительный сосуд 7, откуда 20%-я кислота, после смешения ее со свежей кислотой, возвращается в процесс. Часть HCl-кислоты направляется для орошения в закалочную колонну и в закалочное сопло.
Принципиальная схема процесса окислительного хлорирования полихлоридов С3
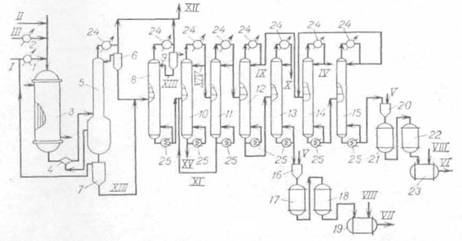
Рис. 1.2.
1,2 - испарители; 3 - реактор; 4 - закалочное сопло; 5 - закалочная колонна; 6, 7, 9, 16, 20 - разделительные сосуды; 8 - колонна осушки; 10 - 15 -ректификационные колонны; 17, 18, 21, 22 - осушители; 19, 23 - сборные емкости; 24 - конденсаторы-холодильники; 25 - кипятильники.
I - НС1; II - воздух; III - полихлориды С3; IV - ССl4; V - NaOH; VI - C2HC13; VII -C2C14; VIII - стабилизатор; IX – ССl4, С2НС13; X - 1,2-дихлорпропан; XI - тяжелая фракция; XII - НС1, СО2; XIII - хлоруглеводороды; XIV - легкая фракция; XV - полихлорпропаны.
Реакционные газы с верха закалочной колонны, пройдя последовательно систему холодильников (водного и рассольного) поступают в разделительный сосуд 6. Водный слой направляется на орошение в закалочную колонну, а хлоруглеводороды из обоих разделительных сосудов 6 и 7 направляются в колонну азеотропной осушки 8. Хлоруглеводороды, содержащие небольшое количество воды, хлороводорода, хлора, диоксида углерода, поступают в колонну 8, где нейтрализуются за счет отгонки растворенных кислых газов и подвергаются азеотропной осушке. В сосуде 9 происходит разделение хлоруглеводородов и воды. Вода направляется на очистку сточных вод, а хлоруглеводороды - на орошение колонны осушки 8. С низа колонны азеотропной осушки хлоруглеводороды направляются на ректификацию (колонны 10-15). Кубовая жидкость колонны 10 представляет собой высококипящие хлоруглеводороды, такие как полихлорпропаны и пентахлорэтан, которые возвращаются в процесс оксихлорирования. В колонне 11 происходит отделение хлоруглеводородов с температурой кипения не выше 130°С, т. е. CCl4, C2HCl3, C2Cl4 и непрореагировавший дихлорпропан.
С верха колонны 12 уходит смесь четыреххлористого углерода и трихлорэтилена, а с низа - смесь тетрахлорэтилена и дихлорпропана. В колонне 13 с верха отгоняется непрореагировавший дихлорпропан, который возвращается в процесс, а с низа - тетрахлорэтилен-ректификат, который после обработки 10%-м раствором NaOH направляется на расслаивание в разделительный сосуд 16. Продукт, пройдя последовательно осушители 17 и 18, заполненные твердым гидроксидом натрия и хлоридом кальция, направляется в емкость 19, где происходит его стабилизация N-метилморфолином.
Для разделения четыреххлористого углерода и трихлорэтилена используются две ректификационные колонны 14 и 15. Четыреххлористый углерод отгоняется с верха колонны 14, а трихлорэтилен - с низа колонны 15. Трихлорэтилен-ректификат также подвергается обработке щелочью (20), сушке (21, 22) и стабилизации триэтиламином (23).
Отходящие газы оксихлорирования, содержащие кислород, диоксид углерода, незначительное количество хлороводорода, хлора и легких хлоруглеводородов, возвращаются в процесс. Часть отходящих газов постоянно выводится из системы и направляется в колонну 14, орошаемую захоложенным 1,2-дихлор-пропаном, где происходит абсорбция почти всех легких углеводородов, хлора, хлороводорода и диоксида углерода. Абсорбированные хлоруглеводороды после десорбции хлороводорода, хлора и диоксида углерода возвращаются в процесс оксихлорирования.
Удельный расход сырья и энергоресурсов при получении перхлоруглеродов окислительным хлорированием отходов хлорорганических производств: хлорорганические отходы - 0,73 т; НС1 - 0,35 т; кислород - 0,33 т; катализатор - 0,3 кг; энергия - 0,40 т. у. т.
Тетрахлорэтилен - универсальный негорючий растворитель, обладающий высокой растворяющей способностью по отношению к жирам, маслам, парафинам, различным смазкам, полимерам, что позволяет применять его для холодного и парового обезжиривания металлов, обработки текстиля, чистки одежды, сольвентной экстракции, в качестве полупродуктов в органическом синтезе, в производстве фреонов, клеев, аэрозольных упаковок, покрытий. Важным преимуществом тетрахлорэтилена является возможность его регенерации.
Мощности по тетрахлорэтилену в 1985 г. составляли в США /7/ - 380 тыс. т, в Европе - 450 тыс. т. Общая мощность для США и стран Западной Европы 1 млн. т/год. Производство в 1985 г. было на уровне 220 тыс. т в США, 100 тыс. т в ФРГ и 600-700 тыс. т в США и Западной Европе.
Производство тетрахлорэтилена в США в 1988 г. составило 224,8 тыс. т, а мощности установок на начало 1989 г. были на уровне 326,9 тыс. т. Спрос в США в 1988 г., в 1989 и 1993 гг. (оценка) находится на уровне 224,7 тыс. т.
0 комментариев