Навигация
Фотохимическое хлорирование
2.1.5 Фотохимическое хлорирование
При этом способе реакция инициируется светом, действие которого наиболее эффективно в коротковолновой части спектра. В этом случае молекулы хлора диссоциируют под влиянием фотонов или квантов энергии /6/:
![]() (2.15)
(2.15)
в качестве источника которых применяются ртутные лампы, излучающие свет длиной волны 1650-5500 А. Если реакционные устройства сделаны из плавленого кварца, можно использовать лучи с длиной волны 1650 А, если же реактор выполнен из стекла пирекс или из обычного стекла, можно использовать лишь лучи с длинами волны более, 3000-3500 А. Для многих реакций фотохимического хлорирования достаточно уже видимого света с длиной волны 4000-5000 А, для чего применяются обычные мощные лампы. Эффективность действия излучения характеризуется квантовым выходом, т. е. числом прореагировавших молекул на один квант поглощенной энергии.
Цепная реакция фотохимического хлорирования протекает с большой скоростью при невысоких температурах в жидкой или паровой фазе, а направление реакции часто бывает иным, чем при термическом хлорировании. Энергия активации при фотохимическом хлорировании равна 42 кДж/моль, т. е. примерно в 2,5-3 раза ниже, чем при термическом хлорировании.
Реакция фотохимического хлорирования ингибируется (замедляется) некоторыми примесями, которые связывают атомы хлора и обрывают цепь. К таким ингибиторам относится, например, кислород, который с атомами хлора образует оксид хлора:
![]() (2.16)
(2.16)
Однако кислород тормозит реакцию лишь при низких температурах, а при 350-400°С он уже не оказывает заметного действия, что связано с переходом к другому механизму /6/.
2.1.6 Хлорирование в присутствии свободных радикалов
Инициаторами жидкофазного хлорирования являются органические пероксиды и азосоеднинения, вызывающие образование атомов хлора при своем распаде на радикалы. Такими инициаторами являются бензоилпероксид и азодиизобутиронитрил:
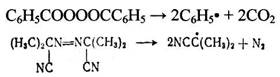 (2.17)
(2.17)
Образовавшиеся свободные радикалы взаимодействуют с молекулой хлора с образованием атомарного хлора:
![]() (2.18)
(2.18)
В присутствии инициатора скорость хлорирования определяется стадией распада инициатора: при использовании бензоилпероксида скорость оказывается достаточной при 100-120°С, а в случае азодиизобутиронитрила при 70-100°С; энергия активации реакции хлорирования с инициатором ~84 кДж/моль.
Заместительное хлорирование проводят также ив присутствии катализаторов, образующих с хлором активные соединения или комплексы, служащие передатчиками атомов С1. Для этой цели применяются хлориды металлов, имеющих переменную валентность.
По-видимому, в этом случае возможны реакции передачи атомов хлора
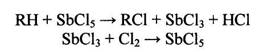 (2.19)
(2.19)
и образования радикалов:
![]() (2.20)
(2.20)
Обрыв цепи при хлорировании в газовой фазе происходит на стенке реактора или насадке
![]() (2.21)
(2.21)
2.1.7 Ионно-каталитическое хлорирование
Присоединение хлора по двойной и тройной связям, хлоргидринирование (присоединение НС1О) и гидрохлорирование (присоединение НС1) олефинов, а также замещение хлором водородов ароматического кольца относятся к ионно-каталитическому галогенированию.
Присоединение хлора, а также галогеноводородов к ненасыщенным углеводородам идет достаточно легко, ускоряют эти реакции апротонные катализаторы FeCl3, AICl3 и др. Механизм реакций является электрофильным, идет через образование промежуточных p- и s-комплексов:
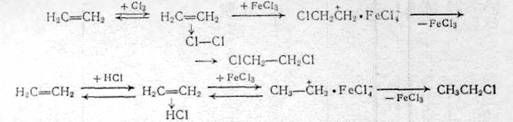 (2.22)
(2.22)
Роль FeCl3 сводится не только к ускорению стадии перехода p- в s-комплекс, но образованием комплекса С1 ® Cl: FeCl3 (присоединение хлора) и металлхлористоводородной кислоты НА1С14 или HFeCl4 (гидрохлорирование), имеющей активный протон.
В процессах присоединения хлора к олефинам побочными продуктами являются полихлориды, что предотвращают применением ингибиторов цепных реакций (кислород).
Реакционная активность олефинов зависит от стабильности промежуточного катиона и уменьшается в следующем ряду:
![]() (2.23)
(2.23)
присоединение галогеноводородных кислот к ацетиленовым углеводородам идет последовательно в две стадии:
![]() (2.24)
(2.24)
Поэтому гидрохлорирование ацетилена проводят в присутствии селективных катализаторов, ускоряющих только первую стадию. В основном применяют соли двухвалентной ртути (раньше) и одновалентной меди.
Каталитическое действие этих солей объясняют образованием координационных комплексов, в которых ацетилен активируется и взаимодействует с хлоранионами, при этом промежуточно получаются переходные состояния с металл - углеродной связью или металлорганические соединения, быстро разлагаемые кислотой:
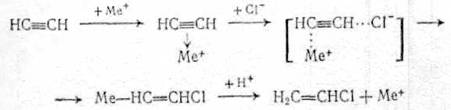 (2.25)
(2.25)
Присоединение галогеноводородных кислот к ненасыщенным углеводородам идет согласно правилу Марковникова, т. е. водород идет к наиболее гидрированному углероду, а хлор - к менее гидрированному.
В промышленности процесс хлорирования осуществляют как в газовой, так и в жидкой фазе.
0 комментариев