Навигация
Метод замещения (субститутивное галогенирование)
2.1.1 Метод замещения (субститутивное галогенирование)
Из реакций замещения наибольшее промышленное значение имеет замещение атомов водорода на галоген, которое может происходить при насыщенном и ненасыщенном атомах углерода и в ароматической системе:
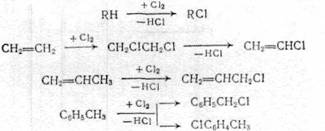 (2.1)
(2.1)
Замещение одного атома галогена на другой применяется при синтезе фтор-, бром- и иодпроизводных из более доступных хлорорганических производных:
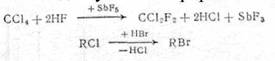 (2.2)
(2.2)
Замещение функциональной группы, например, в спиртах, кислотах:
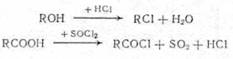 (2.3)
(2.3)
2.1.2 Метод присоединения (аддитивное галогенирование) галогенирующих агентов
Галогены способны присоединяться по двойной и тройной связям алифатических и ароматических углеводородов:
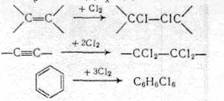 (2.4)
(2.4)
Галогеноводороды присоединяются по двойной и тройной связям (гидрогалогенирование):
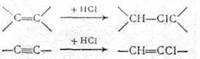 (2.5)
(2.5)
олефины также вступают в реакцию хлоргидринирования
![]() (2.6)
(2.6)
Особым случаем присоединения хлора является получение фосгена из оксида углерода и хлора, т. е. хлор присоединяется к атому углерода, находящемуся в низшей валентности:
![]() (2.7)
(2.7)
2.1.3 Метод расщепления галогенпроизводных
К этому методу относятся следующие реакции: дехлорирование:
![]() (2.8)
(2.8)
дегидрохлорирование:
![]() (2.9)
(2.9)
расщепление связи С-С под влиянием хлора (хлоролиз):
![]() (2.10)
(2.10)
и высокой температуры (пиролиз):
![]() (2.11)
(2.11)
Все процессы галогенирования по механизму делятся на две группы: радикально-цепные и ионно-каталитические.
Парафиновые углеводороды независимо от молекулярной массы хлорируются путем последовательного замещения атомов водорода на хлор. Низшие олефиновые углеводороды хлорируются радикально-цепным путем преимущественно в газовой фазе.
При этом конкурируют две реакции: присоединение хлора по двойной связи и замещение атомов водорода:
![]() (2.12)
(2.12)
С увеличением длины углеводородной цепи и повышением температуры роль реакций присоединения уменьшается. Заместительное хлорирование с повышением температуры предпочтительно протекает в наиболее реакционноспособное аллильное положение. Ароматические углеводороды хлорируются радикально-цепными путями даже в отсутствие катализаторов ионных реакций FeCl3, A1C13, а также соответствующих металлов, что ограничивает выбор материала аппаратуры. При этом конкурируют три вида реакций: замещение в боковую цепь, замещение в кольцо и присоединение по С-С связи кольца.
Для алкилароматических углеводородов замещение предпочтительно идет в а-положение с последовательным замещением атомов водорода.
При пониженных температурах наблюдается присоединение хлора по С-С связи кольца, а при повышенных идет замещение в кольцо.
Все рассматриваемые процессы относятся к неразветвленным цепным реакциям, протекающим через промежуточное образование радикалов и свободных атомов.
В соответствии с применяемым способом инициирования реакции существует термическое, фотохимическое, инициированное и каталитическое хлорирование.
Первым актом зарождения цепи является гемолитическая диссоциация молекулы хлора на атомы.
2.1.4 Термическое хлорирование
Осуществляется в газовой фазе под действием тепла. Для этого требуется нагревание до 250°С; при такой температуре становится заметной диссоциация молекул хлора на атомы с участием стенки или насадки:
![]() (2.13)
(2.13)
При сравнительно низких температурах образование свободных атомов происходит в основном за счет взаимодействия хлора с углеводородом:
![]() (2.14)
(2.14)
Чем менее реакционноспособны углеводороды, тем выше должна быть температура, так как образование свободных органических радикалов связано с разрывом связи С-Н в молекуле углеводорода. Например, температура хлорирования бутана составляет около 250°С, а для термического хлорирования метана требуется 400°С. Энергия активации термического хлорирования равна 125 кДж/моль.
Термическое хлорирование при высоких температурах может сопровождаться побочными реакциями, деструкцией молекул, дегидрохлорированием и циклизацией.
0 комментариев