Навигация
Уравнения, отражающие равенство количества - ценного компонента, поступающего на операцию, количеству, выходящему с нее:;
3. Уравнения, отражающие равенство количества - ценного компонента, поступающего на операцию, количеству, выходящему с нее:;
Ха + Хз = Xi + *2 • или Хз = xl;
х4 + х5 = х3, Х6 + Х7 = Х4,
Х8 + Х9 = Хб + Х12 И Т.Д.
Легко убедиться, что общее число уравнений всех типов, которые можно составить, во много раз превышает число неизвестных, хотя система должна иметь единственное решение и соответственно число уравнений должно быть равно числу неизвестных. Причина, очевидно, состоит в том, что большая часть уравнений представляет собой линейные комбинации других; например, из
Х2 = 0,2 (Хт + Х2),
Х3 = 0,8 (Xi + Х2) следует
Ха + Хз = Xi + х2, или Хз = Xi;
Хз: Х2 = 0,8: 0,2, или Х3 = 4Х2.
В то же время решение возможно только при условии, что при числе уравнений, равном числу неизвестных, все уравнения линейно независимы. Поэтому после составления системы уравнений необходим тщательный контроль отсутствия в ней линейно зависимых (дублирующих) уравнений.
По-видимому, дублирования уравнений проще всего избежать, используя в системе, кроме уравнения, задающего производительность, только соотношения между количеством ценного компонента в потоке, выходящем с операции, и количеством, поступающим на эту операцию. Для схемы, показанной на рис.7, можно составить, например, следующую систему уравнений для определения потоков ценного компонента при производительности по конечному продукту, равной 1000:
1. Х2 = 0,2 (х-i + Х2), или Х2 = 0,25 Xi;
2. х3 = 0,8(х1 +х2);
3. х4 = о. з Хз;
4. Х5 = 0,7 Хз;
5. Хб = 0,98 Х4;
б ху = 0,02 х4;
7. х8 = 0,05 (х6 + х12);
8. Х9 = 0,95(Х6 + Х12);
э. хю = 0,01 х9;
10. Хц =0,99 Xg;
11. х12 = о,1 (хб + хц);
12. Х13 = 0,9(Х5 + Хц);
13. Х13 = 1000.
Подобную систему уравнений можно довольно легко решить вручную, путем последовательной подстановки, сокращения переменных при вычитании одних уравнений из других и т.д. Однако если число неизвестных очень велико (а в реальных схемах число потоков может достигать многих десятков и даже сотен), возрастает трудоемкость расчетов и вероятность ошибок. В подобных случаях для сокращения числа уравнений можно рекомендовать обозначать неизвестными не количества ценного компонента в каждом из потоков, а суммарные количества, поступающие на операции схемы; при этом, очевидно, число уравнений на 1 больше числа операций. Например, для той же схемы (рис.7) получаем:
1. У1 = G ucx + 0,2 /!, или 0,8 у! = G исх;
2. у2 = 0,8 yi;
3. уз = о, з у2;
4. у4 = 0,98 Уз + 0,1 Уб',
5. у5 = 0,95 у4;
6. у6 = 0,7 у2 + 0,99 у5;
7. G исх = 0,9 у6.
После решения подобной системы уравнений расчет количества ценного компонента в каждом из потоков не вызывает затруднений.
Однако наиболее эффективным способом преодоления трудностей расчета сложных технологических схем является использование компьютеров.
В отличие от человека, выбирающего для каждой конкретной системы уравнений наиболее рациональный путь решения, в программах для цифровых вычислительных машин можно использовать только универсальные, единые для всех систем линейных уравнений способы вычисления. Среди таких способов наиболее распространены метод Гаусса с выбором главного элемента столбца или строки и метод обращения матрицы [2].
До начала вычислений необходимо ввести исходные данные: при использовании метода Гаусса - расширенную матрицу коэффициентов системы линейных уравнений (значения коэффициентов при неизвестных и свободные члены каждого из уравнений):

а при использовании метода обращения матрицы - отдельно квадратную матрицу коэффициентов и вектор-столбец свободных членов:
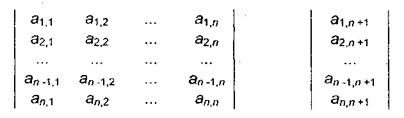
Для составления матрицы коэффициентов члены уравнений, содержащие неизвестные, необходимо расположить слева от знака равенства в порядке возрастания индекса неизвестного, оставив справа только свободные члены; отсутствующие неизвестные вносят в уравнения с коэффициентами, равными нулю. После этого можно приступить к вводу матрицы коэффициентов.
Однако применительно к системе уравнений, получаемой при описании распределения ценного компонента по потокам технологической схемы, этот способ нерационален, так как подавляющая часть коэффициентов равна нулю. Например, при вводе коэффициентов составленной ранее системы из 13 уравнений первые две строки должны быть записаны в следующем виде: - 0,25 Xi + 1 Х2 + О Х3 + О Х4 + О Х5 + О Х6 + О Х7 + О Х8 + О Х9 +
+ о х10 + о хп + ох12+ о х13 = о;
- 0,8 х1 - 0,8 х2 + 1 хЗ + 0 х4 + 0 х5 + 0 хб + 0 х7 + 0 х8 + О Х9 +
+ о Хю+ о х-и +о X-I2 + о х13 = о,
а первые две строки расширенной матрицы коэффициентов соответственно
-0,25 1 000000000000 - 0,8 - 0,8 000000000000
При большом числе неизвестных количество вводимых нулей становится громадным: например, при 40 неизвестных расширенная матрица состоит из 40 х 41 = 1640 коэффициентов, из которых более 1500 будут равны нулю. Очевидно, что ввод подобной матрицы настолько трудоемок и неизбежно сопровождается таким количеством ошибок, что превращается в сложную задачу.
Это затруднение устраняется, если ввод матрицы осуществлять в два этапа: сначала заполнить всю матрицу нулями (эта операция выполняется очень легко), а затем ввести ненулевые коэффициенты, заменяя ими нули.
Ниже описан расчет балансов по ценному компоненту методом Гаусса с помощью программы на языке BASIC и методом обращения матрицы с помощью табличного процессора EXCEL [3, 4].
5.1. Уравнения материального баланса.![]() + 0,4 ·
+ 0,4 · ![]() +
+ ![]() +
+ ![]()
![]()
![]()
![]()
G23 = 12043 + 10174,5 + ![]() + 0,4 ·
+ 0,4 · ![]() +
+ ![]() +
+
![]()
![]()
![]()
![]() =
=
![]()
![]()
![]()
![]()
Xi=Xo+XK2i i+XO2l 1+X21+X221
Хо=166,67
Хк211=0,2*0,1 *(0,78+0,15) *Xi
X2i=0,65*0,02*(0,78+0,15) *X1
X22i=0,15*0,01*(0,78+0,15) *Xi
0,1 - не окислившегося карбида в циклоне
0,02 - доля не окислившегося карбида в огарке
0,01 - доля не окислившегося карбида в рукаве
Получим:
Хк211=0,019*Xi
X2i=0,012*X!
Х221=0,001*Х!
Решение:
X1-0,019*Xi-0,012*X1-0,001*X1=166,67
0,968*Х1=166,67
Ху=172Л8 (без оксидов и связующих компонентов)
5.1.1. Расчет потоков:Поток Хк2ц равен:
Хи„=3, 202
Найдем количества веществ в этом потоке:
Xk2ii(WC): 0,2*0,78*0,1*172,18=2,686
ХииСТЮ): 0,2*0,15*0,1*172,18=0,516
Поток X2i равен:
Х2] =2,082
Найдем количества веществ в этом потоке:
X2i(WC): 0,65*0,02*0,78*172,18=1,746 X2i(TiC): 0,65*0,02*0,15*172,18=0,336
Поток X22i равен:
X22i(WC): 0,15*0,01*0,78*172,18=0, 201
X22i(TiC): 0,15*0,01*0,15*172,18=0,039
5.1.2. Расчет циклонной пыли.Количество карбида окисляемого в циклоне в виде металлов (Со, Zn, Cu, Fe), (кг/ч): 3, 202*(0,06+0,006+0,003+0,001) /(0,78+0,15) = 0,241
Количество оксидов в циклоне без учета оксидов поступающих из шихты:
X'o22i = 0,2 *0,9*Xi=30,992
Количества оксидов, (кг/ч):
По реакции (1) WO3: 0,78*30,992*231,82/195,86=28,612
По реакции (2) ТЮ2: 0,15*30,992*79,88/59,84=6, 206
По реакции (3) СоО: (0,06*(30,992+0,241)) *74,93/58,93=2,383
По реакции (4) ZnO: (0,06*(30,992+0,241)) *81,39/65,39=0,233
По реакции (5) Си2О: (0,06*(30,992+0,241)) *143,1/2*63,55=0,105
По реакции (6) Fe2O3: (0,06*(30,992+0,241)) *231,55/2*55,85=0,065
Суммарное количество оксидов, (кг/ч): 37,604
Таблица 6. Количество оксидов в циклоне без учета оксидов поступающих из шихты.
| W03 | ТЮ2 | СоО | ZnO | Cu2O | Fe203 | всего | |
| кг/ч | 28,612 | 6, 206 | 2,383 | 0,233 | 0,105 | 0,065 | 37,604 |
| % | 76,088 | 16,504 | 6,337 | 0,620 | 0,279 | 0,173 | 100 |
Итоговое количество оксида в шихте:
Хо2ц=37,604+0,2*Хо2ц
0,8*Х211=37,604
Xo2i 1=47,005 кг/ч
Количество оксида приходящее из шихты в циклон:
0,2*Xo2i 1=9,401 кг/ч
Состав и количество приходящих в циклон оксидов их шихты, (кг/ч):
WO3: 9,401*0,761=7,154
ТЮ2: 9,401*0,165=1,551
СоО: 9,401*0,063=0,592
ZnO: 9,401*0,006=0,056
Cu20: 9,401*0,003=0,028
Fe2O3: 9,401*0,003=0,019
Итоговое суммарное состав и количество оксидов, (кг/ч):
WO3: 7,154 + 28,612=35,766
ТЮ2: 1,551+6, 206=7,757
СоО: 0,592+2,383=2,975
Си20: 0,028+0,105=0,133
ZnO: 0,056+0,233=0,289
Fe2O3: 0,019+0,065=0,084
5.1.4. Количество связующих веществ в исходной шихте.Количество WC в шихте, (кг/ч): 166,67*0,76+1,746+2,686+0, 201=134,636 Количество ТЮ в шихте, (кг/ч):
166,67*0,15+0,516+0,336+0,039=25,531 Количество шихты без связующих веществ, (кг/ч): 166,67+47,005+0,24+2,082,3, 202=219, 199
Количество связующих веществ 219, 199*(14%+6%) /80%:
Н2О: 219, 199*0,14/0,8=38,360 кг/ч Хшо=3 8,360 кг/ч
Бентонита: 219, 199*0,06/0,8=16,440кг/ч Распределение бентонита, (кг/ч):
огарок: 16,440*0,65=10,686
пыль циклона: 16,440*0, 20=3,288
пыль рукавного фильтра: 16,440*0,15=2,466 Хбент. =16,440 - 3,288=13,152
Таблица 7. Состав шихты поступающей на обжиг.
| WC | ТЮ | Со | Zn | Си | Fe | W03 | ТЮ2 | СоО | ZnO | Си2О | Fe2O3 | Н2О | бенг | всего |
| кг/ч 134,636% 49, 202 | 25,531 9,330 | 10,000 3,654 | 1,000 0,365 | 0,500 0,183 | ОД 67 0,061 | 35,766 13,071 | 7,757 2,835 | 2,975 1,087 | 0,289 0,106 | 0,133 0,049 | 0,084 0,031 | 38,360 14,019 | 16,440 6,008 | 273,638 100,000 |
Распределение компонента, (кг/ч):
огарок: 134,636*0,65=87,513
пыль циклона: 134,636*0, 20=26,927
пыль рукавного фильтра: 134,636*0,15=20, 195
Основная реакция: WC + 2.5О? = WCb + ССЬ
М=195,86 М=16 М=231,82 М=44,01 (г/моль)
1) в огарке окислится: 26,927*0,9= 85,763 кг/ч Расходуется кислорода, (кг/ч):
02: 85,763*2,5*2*16/195,86=17,515
Образуется веществ, (кг/ч):
С02: 85,763*44,01/195,86=19,272
WO3: 85,763*231,82/195,86=101,509
Оксида WO3 в исходной шихте, (кг/ч): 47,005*0,65*0,761=23,251
Суммарное количество WOs, (кг/ч): 124,76
2) в циклоне окислится: 26,927*0,9=24,234 кг/ч Расходуется кислорода, (кг/ч):
О2: 24,334 * 2,5*2*1,6/195,86 = 4,949 Образуется веществ, (кг/ч): СО2: 24,334*44,01/195,86=5,445
WO3: 28,612
Оксида WO3 в исходной шихте, (кг/ч): 47,005*0,2*0,761=7,154
Суммарное количество WO3, (кг/ч): 35,76
3) в рукаве окислится: 20, 195*0,99=19,993 кг/ч
Расходуется кислорода, (кг/ч):
О2: 19,993*2,5*2*16/195,86=4,083
Образуется веществ, (кг/ч):
СО2: 19,993*44,01/195,86=4,492
W03: 19,993*231,82/195,86=23,664
Оксида WO3 в исходной шихте, (кг/ч): 47,005*0,15*0,761=5,366
Суммарное количество WO3, (кг/ч): 29,03
5.2.2. Окисление TiC:Распределение компонента, (кг/ч):
огарок: 25,531*0,65=16,595
пыль циклона: 25,531*0, 20=5,106
пыль рукавного фильтра: 25,531*0,15=3,830
Основная реакция: TiC + 2OZ = TIP? + СО?
M=59,84 M=16 М=79,88 М=44,01 (г/моль)
1) в огарке окислится: 16,595* 0,98=10,787 кг/ч Расходуется кислорода, (кг/ч):
02: 10,787*2*2* 16/59,84=5,768 кг/ч
Образуется веществ, (кг/ч):
ТЮ2: 10,787*79,88/59,84=14,399
СО2: 10,787*44,01/59,84=7,933
Оксида ТЮ2 в исходной шихте, (кг/ч): 47,005*0,65*0,165=5,042
Суммарное количество ТЮ2, (кг/ч): 12,975
2) в циклоне окислится: 5,106*0,9 =3,319 кг/ч Расходуется кислорода, (кг/ч):
О2: 3,319*2*2*16/59,84=1,331
Образуется веществ, (кг/ч):
СО2: 3,319*44,01/59,84=2,441
ТЮ2: 6, 206
Оксида ТЮ2 в исходной шихте, (кг/ч): 47,005*0, 20*0,165=1,551
Суммарное количество ТЮ2, (кг/ч): 12,975
3) в рукаве окислится: 3,830*0,99=2,498 кг/ч Расходуется кислорода, (кг/ч):
02: 2,489*2*2*16/59,84=1,331
Образуется веществ, (кг/ч):
ТЮ2: 2,489*79,88/59,84=3,322
С02: 2,489*44,01/59,84=1,831
Оксида ТЮ2 в исходной шихте, (кг/ч): 47,005*0,15*0,165=1,163
Суммарное количество ТЮ2, (кг/ч): 4,485
5.2.3. Окисление Со:Распределение компонента, (кг/ч):
огарок: 10*0,65=6,5
пыль циклона: 10*0,2=2,0
пыль рукавного фильтра: 10*0,15=1,5
Реакции: а) Со + 0.5От= СоО
М=58,93 М=16 М=74,93 (г/моль)
б) 2СоО + 0.5О7 = CozCb М=74,93 М=16 М=165,86 (г/моль)
Весь СоО оседает в циклоне, а Со2Оз образуется в огарке и пыли рукавного фильтра. СоО приходящий с исходной шихтой (оборотный) окисляется до Со2Оз нацело.
1) в огарке окислится: 6,5кг/ч По реакции (а):
Расходуется кислорода, (кг/ч):
О2: 6,5* 16/58,93=1,765 Образуется веществ, (кг/ч):
Считаем, что СоО из шихты образуется 100% -98%=2%: 6,5* 2%=0,13
Из этого СоО по реакции (б) не будет доокисляться: 0,13*74,94/58,93=0,165
СоО: 6,5*74,93/58,93=8,265
По реакции (б):
Расходуется кислорода, (кг/ч):
О2: 8,965*16/165,86=0,865 Образуется веществ, (кг/ч):
СогО3: (8,265-0,165) * 165; 86/2*7,493=8; 965
Оксида СоО в исходной шихте, (кг/ч): 47,005*0,65*0,063=1,934 Со203: 1,934*165,86/2*7,493=2,140 Суммарное количество Со2Оз, (кг/ч): 11,105
2) в огарке окислится: 2,0 кг/ч
В циклоне окисление идет до СоО.
Расходуется кислорода, (кг/ч):
О2: 2,0*16/58,93=0,543
Образуется веществ, (кг/ч):
СоО: 2,383
Оксида СоО в исходной шихте, (кг/ч): 47,005*0, 20*0,0,063=0,592
Суммарное количество СоО, (кг/ч): 2,975
3) в рукаве окислится: 1,5 кг/ч По реакции (а):
Расходуется кислорода, (кг/ч):
О2: 1,5*16/58,93=0,407 Образуется веществ, (кг/ч):
Считаем, что СоО из шихты образуется 100% -99%=1%: 1,5* 1%=0,015
Из этого СоО по реакции (б) не будет доокисляться: 0,015*74,94/58,93=0,019
СоО: 1,5*74,93/58,93=1,907
По реакции (б):
Расходуется кислорода, (кг/ч):
О2: (1,907 - 0,019) * 16/165,86=0,182
Образуется веществ, (кг/ч):
Со2О3: (1,907-0,019) * 165,86/2*74,93=2,091
Оксида СоО в исходной шихте, (кг/ч): 47,005*0,15*0,063=0,444
Со203: 0,444*165,86/2*74,93=0,492
Суммарное количество Со2Оз, (кг/ч): 2,583
5.2.4. Окисление Zn:Распределение компонента, (кг/ч):
огарок: 1,0*0,65=0,65
пыль циклона: 1,0*0, 20=0, 20
пыль рукавного фильтра: 1,0*0,15=0,15
Основная реакция: Zn + 0,50? = ZnO
М=65,39 М=16 М=81,39 (г/моль)
1) в огарке окислится: 0,65 кг/ч Расходуется кислорода, (кг/ч):
О2: 0,65*16/65,39=0,159 Образуется веществ, (кг/ч):
ZnO: 0,65*81,39/65,39=0,809
Оксида ZnO в исходной шихте, (кг/ч): 47,005*0,65*0,006=0,188 Суммарное количество ZnO, (кг/ч): 0,997
2) в циклоне окислится: 0,2 кг/ч Расходуется кислорода, (кг/ч):
02: 0,2*16/65,39=0,049 Образуется веществ, (кг/ч):
ZnO: 0,233
Оксида ZnO в исходной шихте, (кг/ч): 47,005*0, 20*0,006=0,056 Суммарное количество ZnO, (кг/ч): 0,289
3) в рукаве окислится: 0,15кг/ч Расходуется кислорода, (кг/ч):
02: 0,15*16/65,39=0,037 Образуется веществ, (кг/ч):
ZnO: 0,15*81,39/65,39=0,187
Оксида ZnO в исходной шихте, (кг/ч): 47,005*0,15*0,006=0,043 Суммарное количество ZnO, (кг/ч): 0,230
5.2.5. Окисление Си:Распределение компонента, (кг/ч):
огарок: 0,5*0,65=0,325
пыль циклона: 0,5 *0, 20=0,1
пыль рукавного фильтра: 0,5*0,15=0,075
Реакции: а) 2Си + 0.5О2 = СшО
М=63,552 М=16 М=143,1 (г/моль)
![]()
По реакции (а): Расходуется кислорода, (кг/ч): О2: 0,325*16/63,552*2=0,041 Образуется веществ, (кг/ч): Си2О: 0,325*143,1/63,55*2=0,366
Оксида Си2О в исходной шихте, (кг/ч): 47,005*0,65*0,003=0,086
Из исходной шихты Си2О окисляется до СиО нацело. Из окислившегося Си2О по реакциям не будет окисляться до СиО 100% -98%=2%: 0,366*2%=0,007кг/ч Отношение распределения образования оксидов: Cu20/CuO = 2/1 0,366*0,98=0,359 кг/ч следовательно образуется: Си2О=0,244 кг/ч и 0,122 кг/ч идет на доокисление до СиО Суммарное количество Си2О, (кг/ч): 0,007+0,244=0,251
По реакции (б):
Расходуется кислорода, (кг/ч):
О2: 0,232*1/4*32/79,56=0,023
Образуется веществ, (кг/ч):
СиО: (0,122+0,086) *79,55/143,1* 1/2=0,232
2) в циклоне окислится: 0,1 кг/ч
Будем считать, что реакция идет до образования Си2О.
Расходуется кислорода, (кг/ч):
02: 0,1*16/2*63,55=0,013
Образуется веществ, (кг/ч):
Си20: =0,105
Оксида Си2О в исходной шихте, (кг/ч): 47,005*0, 20*0,003=0,028
Суммарное количество Си2О, (кг/ч): 0,133
3) в рукаве окислится: 0,075кг/ч По реакции (а):
Расходуется кислорода, (кг/ч):
О2: 0,075*169/2*63,55=0,009 Образуется веществ, (кг/ч):
Си2О: 0,075*143,1/63,55*2=0,084
Оксида Си2О в исходной шихте, (кг/ч): 47,005*0,15*0,003=0,002
Из исходной шихты Си2О окисляется до СиО нацело. Из окислившегося Си2О по реакциям
не будет окисляться до СиО 100% -99%=2%: 0,084*1%=0,001кг/ч
Отношение распределения образования оксидов: Cu20/CuO = 2/1
0,084*0,99=0,083 кг/ч следовательно образуется:
Си2О=0,056 кг/ч и 0,028 кг/ч идет на доокисление до СиО
Суммарное количество Си2О, (кг/ч): 0,001+0,056=0,057
По реакции (б):
Расходуется кислорода, (кг/ч):
О2: 0,053*1/4*32/79,55=0,005
Образуется веществ, (кг/ч):
СиО: (0,028+0,133*0,15) *79,55=0,005
5.2.6. Окисление Ге:Распределение компонента, (кг/ч):
огарок: 0,167*0,65=0,108
пыль циклона: 0,167*0,2=0,033
пыль рукавного фильтра: 0,167*0,15=0,025
Реакции: a) Fe + 0.50? = FeO
М=55,85 М=16 М=71,85 (г/моль)
![]()
1) в огарке окислится: 0,108 кг/ч
Отношение распределения образования оксидов: РеаОз/ FeO =3/1=0,081/0,027
По реакции (а):
Расходуется кислорода, (кг/ч):
О2: 0,027*16/55,85=0,008
Образуется веществ, (кг/ч):
FeO: 0,027*71,85/55,85=0,035
По реакции (б):
Расходуется кислорода, (кг/ч):
02: 0,081*1,5*32/55,85*2=0,04
Образуется веществ, (кг/ч):
FeiOs: 0,081*159,7/2*55,85=0,116
Оксида FeiOs в исходной шихте, (кг/ч): 47,005*0,65*0,002=0,065
Суммарное количество Ре2Оз, (кг/ч): 0,181
2) в циклоне окислится: 0,033кг/ч
В циклоне окисление идет до РеаОз.
Расходуется кислорода, (кг/ч):
О2: 0,033*1,5*32/55,85*2=0,014
Образуется веществ, (кг/ч):
РегОз =0,065
Оксида Ре2Оз в исходной шихте, (кг/ч): 47,005*0, 20*0,002=0,019
Суммарное количество Ре2Оз, (кг/ч): 0,084
1) в огарке окислится: 0,025 кг/ч
Отношение распределения образования оксидов: РезОз/ FeO =3/1=0,019/0,006
По реакции (а):
Расходуется кислорода, (кг/ч):
О2: 0,006*16/55,85=0,002
Образуется веществ, (кг/ч):
FeO: 0,006*71,85/55,85=0,008
По реакции (б):
Расходуется кислорода, (кг/ч):
О2: 0,019*1,5*32/55,85*2=0,008
Образуется веществ, (кг/ч):
FeiOs: 0,019*159,7/2*55,85=0,027
Оксида Ре2Оз в исходной шихте, (кг/ч): 47,005*0,15*0,002=0,013
Суммарное количество Ре2Оз, (кг/ч): 0,04
5.2.7. Теоретическое количество воздуха.Суммарное количество кислорода, (кг/ч): 35,03+9,939+11,563+3,55+2,662+ 1,765+0,865 +0,543+0,407+0,182+0,159+0,049+0,037+0,023+0,013+0,009+0,005+0,003+ 0,008+ 0,014+0,002+0,008=75,043
Теоретический расход воздуха (из расчета. Оа - 23% по массе)
75,043*0,23=326,274 кг/ч
Количество азота: 326,274 - 75,043= 251,231 кг/ч
Количество влаги, вносимое с воздухом при Т=20°С и относительной влажности 80%
(содержание влаги "0,012 кг. на 1кг. сухого воздуха):
326,274* 0,012 = 3,915 кг/ч
Теоретический расход влажного воздуха (кг/ч)
326,274 + 3,915 = 330,189 кг/ч.
Таблица 8. Состав огарка.
| Со203 |
| 11,105 |
| 6,793 |
| WC | ТЮ | Со | Zn | Си | Fe | WO3 | ТЮ2 | СоО | ZnO | Си2О | Fe203 | H20 | Бент. всего | ||
| кг/ч | 1,746 | 0,336 | 0 | 0 | 0 | 0 | 124,760 | 12,975 | 0,165 | 0,997 | 0,251 | 0,181 | 0 | 10,686 163,469 | |
| % | 1,068 | 0, 206 | 0 | 0 | 0 | 0 | 76,320 | 7,937 | 0,101 | 0,610 | 0,154 | 0,111 | 0 | 6,537 100,000 | |
| СиО FeO |
| ||||||||||||||
| 0,232 0,035 |
| ||||||||||||||
| 0,142 0,021 |
| ||||||||||||||
Таблица 9. Состав циклонной пыли.
| WC | TiC | Со | Zn | Си | Fe | WO3 | ТЮ2 | СоО | ZnO | Си2О | Fe2O3 | Н2О | Бент. | всего | |
| кг/ч | 2,686 | 0,516 | 0 | 0 | 0 | 0 | 35,766 | 7,757 | 2,925 | 0,289 | 0,133 | 0,084 | 0 | 3,288 | 53,444 |
| % | 5,026 | 0,965 | 0 | 0 | 0 | 0 | 66,922 | 14,514 | 5,473 | 0,541 | 0,249 | 0,157 | 0 | 6,152 | 100,000 |
Таблица 10. Состав пыли рукавного фильтра.
| Со2ОЗ |
| 2,583 |
| 6,587 |
| WC | TiC | Со | Zn | Си | Fe | WO3 | ТЮ2 | СоО | ZnO | Си2О | Fe2O3 | H2O | Бент. | всего | |||
| кг/ч | 0, 201 | 0,039 | 0 | 0 | 0 | 0 | 29,030 | 4,485 | 0,019 | 0,230 | 0,057 | 0,040 | 0 | 2,466 | 39,211 | ||
| % | 0,513 | 0,099 | 0 | 0 | 0 | 0 | 74,035 | 11,438 | 0,048 | 0,587 | 0,145 | 0,102 | 0 | 6,289 | 100,000 | ||
| СиО | FeO |
| |||||||||||||||
| 0,053 | 0,008 |
| |||||||||||||||
| 0,135 | 0,020 |
| |||||||||||||||
Таблица 11. Состав газов.
| N2 кг/ч 251,231 | Н2О 42,275 | СО2 41,414 | всего 334,920 |
| % 75,012 | 12,622 | 12,365 | 100,000 |
Таблица 12. Материальный баланс обжига.
| Г | Приход | Об | разуется | ||
| Вещество | кг/ч | % | Вещество | кг/ч | % |
| WC | 134,636 | 22,366 | WC | 4,633 | 0,786 |
| TiC | 25,531 | 4,241 | TiC | 0,891 | 0,151 |
| Со | 10,000 | 1,661 | |||
| Zn | 1,000 | 0,166 | WO3 | 189,556 | 32,172 |
| Си | 0,500 | 0,083 | ТЮ2 | 25,217 | 4,280 |
| Fe | 0,167 | 0,028 | СоО | 3,109 | 0,528 |
| Со203 | 13,688 | 2,323 | |||
| W03 | 35,766 | 5,941 | ZnO | 1,516 | 0,257 |
| ТЮ2 | 7,757 | 1,289 | Си20 | 0,441 | 0,075 |
| СоО | 2,975 | 0,494 | СиО | 0,285 | 0,048 |
| ZnO | 0,289 | 0,048 | Fe203 | 0,305 | 0,052 |
| Си2О | 0,133 | 0,022 | FeO | 0,043 | 0,007 |
| Fe203 | 0,084 | 0,014 | |||
| бент | 16,440 | 2,790 | |||
| бент | 16,440 | 2,731 | |||
| H20 | 40,424 | 6,715 | H20 | 40,424 | 6,861 |
| N2 | 251,231 | 42,640 | |||
| 02 | 75,043 | 12,466 | C02 | 41,414 | 7,029 |
| N2 | 251,231 | 41,734 | |||
| Всего | 601,976 | 100 | Всего | 589, 193 | 100 |
| Нее пр | язка от ихода | 12,783 | 2,124 |
тшо: 3,036*МШо/201,38=0,270
тшо: 0,594*МШо/165,54=0,065
тшо: 0,178*МШо/165,54=0,019 Остаток воды: 547,236-21,251=525,985 кг.
Количество NH3 пошедшее на реакции, (кг/ч):
тотв: 201,227*2*MNH3 (17) 7303,3=22,557
тшз: 0,520* 6*МШЗ /211,93=0,250
тшз: 34,980*12* Мню /211,93=33,670
ткш: 3,036* 6*МШЗ /201,38=1,537
тшз: 0,594*4* Мынз /165,54=0,240
6) тщз: ОД78* 4*МШЗ /165,54=0,078 Остаток NH3: 60,804-58,324=2,480 кг.
Таблица 13. Материальный баланс выщелачивания.
| Приход | Образуется | ||||||
| Вещество WC | кг/ч 1,947 | % 0,236 | Вещество (NH4) 2WO4 | кг/ч 201,227 | % 25,084 |
| |
| TiC | 0,375 | 0,046 | [Co(NH3) 6] (OH) 3 | 35,500 | 4,425 |
| |
| WO3 | 153,790 | 18,662 | [Zn (NH3) 6] (OH) 2 [Cu (NH3) 6j (OH) 2 | 3,036 0,774 | 0,378 0,096 |
| |
| ТЮ2 | 17,460 | 2,119 |
| ||||
| СоО | 0,184 | 0,022 | WC | 1,947 | 0,243 |
| |
| Со203 | 13,688 | 1,661 | TiC | 0,375 | 0,047 |
| |
| ZnO | 1,227 | 0,149 |
| ||||
| Cu20 | 13,688 | 1,661 | ТЮ2 | 17,460 | 2,177 |
| |
| CuO | 0,285 | 0,035 | Fe203 | 0,221 | 0,028 |
| |
| Fe2O3 | 0,221 | 0,027 | FeO | 0,043 | 0,005 |
| |
| FeO | 0,043 | 0,005 |
| ||||
| бент | 13,152 | 1,639 |
| ||||
| бент | 13,152 | 1,596 |
| ||||
| |||||||
| NH3 | 60,804 | 7,378 | NH3 | 2,480 | 0,309 |
| |
| H20 | 547,236 | 66,404 | H20 | 525,985 | 65,568 |
| |
| Всего | 824,100 | 100 | Всего | 802,2 | 100 |
| |
| Невязка от прихода | 21,900 | 2,657 |
| ||||
Сущность метода рассмотрим на примере условной схемы переработки молибденитового концентрата, включающей возгонку триоксида молибдена и гидрометаллургическую переработку остатка от возгонки (рис.7). •
Примем, что пооперационные балансы молибдена характеризуются следующими цифрами:
1) грануляция и обжиг в кипящем слое: в пыль и в огарок переходит соответственно 0,2 и 0,8 количества молибдена, поступающего на операцию;
2) возгонка: в остатке от возгонки 0,3, в возгонах 0,7 количества молибдена;
3) выщелачивание: в растворе 0,98, в отвалах выщелачивания 0,02;
4) очистка от тяжелых металлов: в сульфидном кеке 0,05, в очищенном растворе 0,95;,.
5) нейтрализация: в кислом маточном растворе 0,01, в кристаллах тетрамолибдата аммония 0,99;
6) перекристаллизация: в маточном растворе 0,1, в кристаллах парамолибдата аммония (конечный продукт) 0,9. /
Зададимся производительностью по молибдену в конечном продукте 1000 т/год.
Обозначим потоки молибдена (т.е. количества его в различных материалах), т/год, неизвестными x-i; Хг, - ', Х^2, *13 в соответствии с рис.7.
Для определения неизвестных составим систему, состоящую их уравнений трех типов.
1. Уравнение, в котором задана производительность:
х-i з=1000. " ".
2. Уравнения, в которых использованы соотношения между потоками. Это могут быть непосредственно содержащиеся в исходных данных сведения о доле ценного компонента от количества, поступающего на операцию, переходящей в каждый из продуктов этой операции, например:,
Х2 = 0,2 (xl + Х2), Х3 = 0,8 (Xi + X2), Х4 = 0,3 Х3,
Х5 = 0,7, Х3,
или вытекающие из этих сведений соотношения между потоками, выходящими с одной и той же операции, например:
Х3 = 4Х2,... .
Х5= 7/3 Х4.
Кроме того, возможно использование соотношения между потоками, относящимися к разным операциям схемы. Дело в том, что в реальных технологических схемах количества ценного компонента в тех или иных материалах (особенно в выводимых из схемы) часто задают как долю от количества ценного компонента в исходном материале или конечном продукте. Так, например, исходные данные. могли бы содержать,:; следующее указание: "Потери молибдена с, остатком выщелачивания составляют в среднем 0,6% от количества, поступающего с молибденитовым концентратом"; соответствующее, уравнение имело бы вид
Х7= 0,006 Xi.
Следует отметить, что в тех случаях, когда вместо данных, относящихся к потокам одной и той же операции, заданы соотношения между потоками разных операций, расчет методом "от операции к операции" невозможен.
0 комментариев