Навигация
Строение и энергетические уровни двухатомных молекул
Министерство образования Республики Беларусь
БЕЛОРУСКИЙ ГОСУДАРСТВЕННЫЙ ПЕДАГОГИЧЕСКИЙ ИНСТИТУТ имени МАКСИМА ТАНКА
КУРСОВАЯ РАБОТА
На тему:
Строение и энергетические уровни двухатомных молекул
Выполнил:
студент физического факультета,
303 группы,
Ващилко Сергей Валерьевич
Руководитель:
Маскевич
Минск 2008
Содержание
Введение
1. Спектры и структура атома водорода
1.1 Атом водорода
1.2 Тонкая структура атома водорода.
2. Структура и спектры молекул
2.1 Вращательные спектры
2.2 Колебательно-вращательные спектры
2.3 Электронные спектры
2.4 Инфракрасные спектры и спектры комбинационного рассеяния
3. Электронные состояния двухатомных молекул
4. Электронные конфигурации для молекул
5. Электрические и оптические свойства молекул
6. Молекулы с одинаковыми ядрами
Заключение
Литература
Введение
Молекула (новолат. molecula, уменьшительное от лат. moles — масса), наименьшая частица вещества, обладающая его химическими свойствами. Молекула состоит из атомов, точнее — из атомных ядер, окружающих их внутренних электронов и внешних валентных электронов. Внутренние электроны атомов обычно не участвуют в образовании химических связей.
Атомы объединяются в молекулы в большинстве случаев химическими связями. Как правило, такая связь создаётся одной, двумя или тремя парами электронов, которыми владеют сообща два атома. Молекула может содержать положительно и отрицательно заряженные атомы, т. е. ионы; в этом случае реализуются электростатические взаимодействия. Помимо указанных, в молекуле существуют и более слабые взаимодействия между атомами. Между валентно не связанными атомами действуют силы отталкивания.
Каждый атом и молекула имеют уникальное строение, которому соответствует свой уникальный спектр.
Структура спектра атома, молекулы или образованной ими макросистемы определяется их энергетическими уровнями. Согласно законам квантовой механики, каждый энергетический уровень соответствует определенному квантовому состоянию. Электроны и ядра в таком состоянии совершают характерные периодические движения, для которых энергия, орбитальный момент количества движения и другие физические величины строго определены и квантованы, т.е. принимают лишь разрешенные дискретные значения, соответствующие целым и полуцелым значениям квантовых чисел. Если известны силы, связывающие электроны и ядра в единую систему, то по законам квантовой механики можно рассчитать ее уровни энергии и квантовые числа, а также предсказать интенсивности и частоты спектральных линий.
В атоме наиболее сильное взаимодействие между ядром и электронами обусловлено электростатическими, или кулоновскими силами. Каждый электрон притягивается к ядру и отталкивается всеми остальными электронами. Это взаимодействие определяет структуру энергетических уровней электронов. Внешние (валентные) электроны, переходя с уровня на уровень, испускают или поглощают излучение в ближней инфракрасной, видимой и ультрафиолетовой областях. Энергии переходов между уровнями внутренних оболочек соответствуют вакуумной ультрафиолетовой и рентгеновской областям спектра. Более слабым является воздействие электрического поля на магнитные моменты электронов. Это приводит к расщеплению электронных уровней энергии и, соответственно, каждой спектральной линии на компоненты (тонкая структура). Кроме того, ядро, обладающее ядерным моментом, может взаимодействовать с электрическим полем орбитальных электронов, вызывая дополнительное сверхтонкое расщепление уровней энергии.
1. Спектры и структура атома водорода
1.1 Атом водорода
С точки зрения квантовой механики атом водорода и любой водородоподобный ион (например, He++ и др.) представляют собой простейшую систему, состоящую из одного электрона с массой m и зарядом e, который движется в кулоновском поле ядра, имеющего массу М и заряд +Ze (Z – порядковый номер элемента). Если учитывать только электростатическое взаимодействие, то потенциальная энергия атома равна Ze2/r, и гамильтониан будет иметь вид H = p2/2 Ze2/r, где = тМ/(m + M) m. В дифференциальной форме оператор p2 равен ћ 22, где ћ = h /2. Таким образом, уравнение Шрёдингера принимает вид
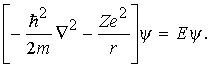
Решение этого уравнения определяет энергии стационарных состояний (Е < 0) водоподобного атома:
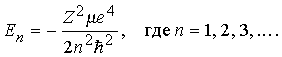
Так как m/M 1/2000 и близко к m, то
En = –RZ2/n2.
где R – постоянная Ридберга, равная R me4/2ћ2 13,6 эВ (или 109678 см1); в рентгеновской спектроскопии ридберг часто используется в качестве единицы энергии. Квантовые состояния атома определяются квантовыми числами n, l и ml. Главное квантовое число п принимает целые значения 1, 2, 3 ... . Азимутальное квантовое число l определяет величину момента количества движения электрона относительно ядра (орбитальный момент); при данном п оно может принимать значения l = 0, 1, 2, ..., п 1. Квадрат орбитального момента равен l(l + l) ћ2. Квантовое число mlопределяет величину проекции орбитального момента на заданное направление, оно может принимать значения ml = 0, 1, 2, ..., l. Сама проекция орбитального момента равна ml ћ. Значения l = 0, 1, 2, 3, 4, ... принято обозначать буквами s, p, d, f, g, ... . Следовательно, уровень 2рводорода имеет квантовые числа п = 2и l = 1.
Спектральные переходы могут происходить отнюдь не между всеми парами уровней энергии. Электрические дипольные переходы, сопровождающиеся наиболее сильными спектральными проявлениями, имеют место лишь при выполнении определенных условий (правил отбора). Переходы, которые удовлетворяют правилам отбора, называются разрешенными, вероятность остальных переходов значительно меньше, они трудны для наблюдения и считаются запрещенными.
В атоме водорода переходы между состояниями пlml и пlml возможны в том случае, если число l изменяется на единицу, а число mlостается постоянным или изменяется на единицу. Таким образом, правила отбора можно записать:
l = l – l = 1, ml = ml = 0, 1.
Для чисел п и п правил отбора не существует.
При квантовом переходе между двумя уровнями с энергиями En и En атом испускает или поглощает фотон, энергия которого равна Е = En En. Поскольку частота фотона = Е/h, частоты спектральных линий атома водорода (Z = 1) определяются формулой
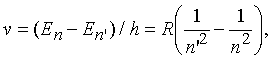
а соответствующая длина волны равна = с/. При значениях п = 2, п = 3, 4, 5, ... частоты линий в эмиссионном спектре водорода соответствуют серии Бальмера (видимый свет и ближняя ультрафиолетовая область) и хорошо согласуются с эмпирической формулой Бальмера n = 364,56 n2/(n2 4) нм. Из сравнения этих двух выражений можно определить значение R. Спектроскопические исследования атомарного водорода – прекрасный пример теории и эксперимента, внесших огромный вклад в фундаментальную науку.
Похожие работы
... . Наконец, в последнее время произошел возврат к несканирующим приборам, в которых в качестве приемника излучения используется так называемая диодная матрица. Это тоже однолучевые приборы. Оптическая схема такого прибора представлена на следующем рисунке (Рис. 11). Продолжительность регистрации полного спектра во всем диапазоне не превышает 1 секунды. Особенностью спектров, получаемых на таких ...
... направленных спинов электронов (в печати недавно появилось сообщение о уникальном эксперименте по получению макроскопических порций атомарного водорода, неспособного соединяться в молекулы из-за того, что все атомы содержали электроны с одинаковым направлением спина). Механизм возникновения ковалентной связи в разнообразных химических соединениях аналогичен. Оптические спектры молекул более ...
... долей) исходных веществ. ► Стехиометрия – раздел химии, в котором рассматриваются массовые или объемные отношения между реагирующими веществами. Законы стехиометрии так же непреложны, как и любые другие естественнонаучные законы; кроме того, их знание очень полезно для прикладной химии, потому что позволяет количественно рассчитать выход химической реакции и необходимое количество исходных ...
... и химических систем; - проанализировать изучение структуры веществ в рамках химической системы. Рассмотрим подробнее концептуальные уровни в познании веществ и химические системы. Состав вещества и химические системы Химическая система – совокупность микро и макро количеств веществ, способных воздействием внешних факторов (условий) к превращениям с образованием новых химических соединений. ...


0 комментариев