Навигация
2.3 Электронные спектры
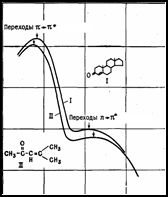
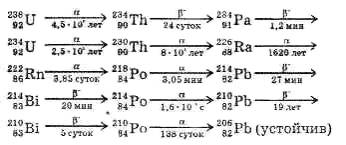
У молекул имеется большое число возбужденных электронных уровней, переходы между которыми сопровождаются изменением колебательной и вращательной энергии. В результате этого структура электронных спектров молекул существенно усложняется, поскольку: 1) электронные переходы часто перекрываются; 2) не соблюдается правило отбора для колебательных переходов (отсутствует ограничение по Dv); 3) сохраняется правило отбора DJ = 0, ±1 для разрешенных вращательных переходов. Электронный спектр представляет собой серию колебательных полос, каждая из которых содержит десятки или сотни вращательных линий. Как правило, в молекулярных спектрах наблюдаются несколько электронных переходов в близкой инфракрасной, видимой и ультрафиолетовой областях. Например, в спектре молекулы йода (J2) имеется около 30 электронных переходов.
С появлением лазеров исследование электронных спектров молекул, вышло на новый уровень. Перестраиваемое в широких пределах интенсивное лазерное излучение используется в спектроскопии высокого разрешения для точного определения молекулярных констант и потенциальных поверхностей.
2.4 Инфракрасные спектры и спектры комбинационного рассеяния
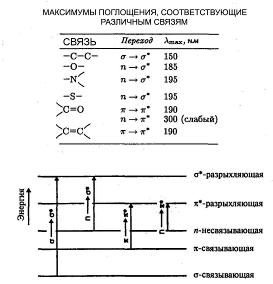
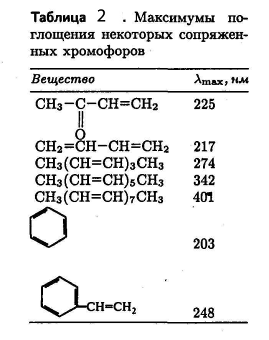
Молекулярные спектры поглощения обусловлены электрическими дипольными переходами. Электрический диполь – это совокупность двух точечных электрических зарядов, равных по величине, противоположных по знаку и находящихся на некотором расстоянии друг от друга. Произведение положительного заряда на расстояние между зарядами называется электрическим дипольным моментом. Чем больше дипольный момент, тем сильнее система может поглощать и излучать электромагнитную энергию. У полярных молекул, таких, как HBr, имеющих большой дипольный момент и сильно поглощающих на соответствующих частотах, наблюдаются колебательно-вращательные спектры. С другой стороны, неполярные молекулы, такие, как Н2, О2 и N2, не имеют постоянного дипольного момента, и, следовательно, не могут при вращении излучать или поглощать электромагнитную энергию, поэтому у них отсутствуют вращательные спектры. К тому же колебания таких молекул столь симметричны, что не приводят к появлению дипольного момента. Этим обусловлено отсутствие у них инфракрасного колебательного спектра.
Важным спектроскопическим методом исследования структуры молекул является изучение рассеяния света. Рассеяние света – это процесс, в котором под действием падающего света в атоме или молекуле возбуждаются колебания дипольного момента, сопровождающиеся излучением полученной энергии. Переизлучение происходит в основном на частоте падающего света (упругое рассеяние), но может наблюдаться слабое неупругое рассеяние на смещенных (комбинационных) частотах. Упругое рассеяние называется рэлеевским, а неупругое – рамановским или комбинационным. Линии, соответствующие комбинационному рассеянию, смещены относительно линии падающего света на частоту молекулярных колебаний рассеивающего образца. Поскольку молекула может еще и вращаться, на частоту смещения налагаются вращательные частоты.
3. Электронные состояния двухатомных молекул
Изложить кратко и в то же время точно теорию электронной структуры молекул нелегко. Поэтому мы по-прежнему ограничимся формулировкой основных понятий, определений и правил. Следуя трактовке Гунда, электронные термы двухатомных молекул подобны термам „соединенного" атома, возникающим при совмещении обоих ядер молекулы в сильном электрическом поле, направленном вдоль линии, соединяющей ядра. Для соединенного атома в случае связи Рэссел-Саундерса сильное электрическое поле приведет к результирующему орбитальному моменту электронов, определяемому квантовым числом L. Этот момент ориентируется по отношению к полю так, что энергия определяется квантовым числом МL, которое принимает значения L, L—1, L —2, ... — L. Отсюда следует, что в пренебрежении взаимодействием с молекулярным вращением, как и в случае эффекта Штарка, термы с равными и имеющими противоположные знаки значениями МL имеют одну и ту же энергию. Поэтому МL фактически принимает лишь значения L, L—1,L —2, ....,0, причем термы с МL>0 состоят из двух совпадающих термов с одной и той же энергией. Для молекулы квантовое число МL заменяется квантовым числом Λ. Оно является самым важным при определении типа молекулярного состояния и аналогично атомному азимутальному квантовому числу L, но не тождественно ему. Подобно тому как атомные состояния с L = 0, 1, 2, 3 и т. д. обозначаются S, Р, D, F и т. д., молекулярные термы с Λ = 0, 1, 2, 3 и т. д. обозначаются соответствующими заглавными греческими буквами Σ, Π, Δ, Φ и т. д. Результирующий спин S соединенного атома расщепляется полем на компоненты с Ms = S, S — 1, S —2, . .. , —S.
Для молекулы это квантовое число Ms заменяется квантовым числом Σ. Мультиплетность снова, как и в случае атомов, равна 2S+1. Это есть число подуровней, на которые терм может быть расщеплен благодаря спину.
Подобно связи Рэссел-Саундерса для атома, в молекуле квантовое число Λ, являющееся результирующим электронным (орбитальным) моментом относительно оси ядер, и квантовое число компоненты спина S относительно той же оси комбинируют между собой (в этом случае путем простого сложения), образуя результирующее квантовое число. Оно обозначается Ω, аналогично атомному J, и принимает значение Ω=Λ+Σ . Продолжая формальную аналогию с термами атомного типа, отмечают мультиплетность, равную 2S+1, числом, расположенным сверху слева от греческой буквы, обозначающей величину Λ, тогда как значение Σ пишется снизу справа от той же буквы. Например, символ 3П2 обозначает молекулярное состояние, для которого мультиплетность равна трем (триплет, спин S=1), Λ=1 и Ω= 2, следовательно, Σ = +1).
Для атомных термов полная мультиплетность фактически реализуется только в том случае, когда L больше или равно S. Для молекул при Λ= 0 (т. е. для Σ-состояний) терм тоже будет одиночным, если пренебречь вращением. Но фактически имеет место малое расщепление, вызванное взаимодействием с вращением молекулы. Для других молекулярных термов мультиплетность реализуется полностью. Состояния с мультиплетностью, превышающей триплетную, встречаются редко, но даже в том случае, когда S превосходит Λ, полная мультиплетность все-таки обнаруживается.
Похожие работы
... . Наконец, в последнее время произошел возврат к несканирующим приборам, в которых в качестве приемника излучения используется так называемая диодная матрица. Это тоже однолучевые приборы. Оптическая схема такого прибора представлена на следующем рисунке (Рис. 11). Продолжительность регистрации полного спектра во всем диапазоне не превышает 1 секунды. Особенностью спектров, получаемых на таких ...
... направленных спинов электронов (в печати недавно появилось сообщение о уникальном эксперименте по получению макроскопических порций атомарного водорода, неспособного соединяться в молекулы из-за того, что все атомы содержали электроны с одинаковым направлением спина). Механизм возникновения ковалентной связи в разнообразных химических соединениях аналогичен. Оптические спектры молекул более ...
... долей) исходных веществ. ► Стехиометрия – раздел химии, в котором рассматриваются массовые или объемные отношения между реагирующими веществами. Законы стехиометрии так же непреложны, как и любые другие естественнонаучные законы; кроме того, их знание очень полезно для прикладной химии, потому что позволяет количественно рассчитать выход химической реакции и необходимое количество исходных ...
... и химических систем; - проанализировать изучение структуры веществ в рамках химической системы. Рассмотрим подробнее концептуальные уровни в познании веществ и химические системы. Состав вещества и химические системы Химическая система – совокупность микро и макро количеств веществ, способных воздействием внешних факторов (условий) к превращениям с образованием новых химических соединений. ...


0 комментариев