Навигация
Тонкая структура атома водорода
1.2 Тонкая структура атома водорода
Рассмотренная выше релятивистская квантово механическая теория уровней в основном подтверждалась анализом атомных спектров, однако не объясняла расщепление и тонкую структуру энергетических уровней атома водорода. Объяснить тонкую структуру уровней атомарного водорода позволил учет двух специфических релятивистских эффектов: спин-орбитального взаимодействия и зависимости массы электрона от скорости. Концепция спина электрона, первоначально возникшая из анализа экспериментальных данных, получила теоретическое обоснование в разработанной П.Дираком релятивистской теории, из которой следовало, что электрон обладает собственным моментом количества движения, или спином, ![]() и соответствующим магнитным моментом
и соответствующим магнитным моментом ![]() . Спиновое квантовое число s равно 1/2, а проекция спина на фиксированную ось принимает значения ms= ±1/2. Электрон, двигаясь по орбите в радиальном электрическом поле ядра, создает магнитное поле. Взаимодействие собственного магнитного момента электрона с этим полем называется спин-орбитальным взаимодействием.
. Спиновое квантовое число s равно 1/2, а проекция спина на фиксированную ось принимает значения ms= ±1/2. Электрон, двигаясь по орбите в радиальном электрическом поле ядра, создает магнитное поле. Взаимодействие собственного магнитного момента электрона с этим полем называется спин-орбитальным взаимодействием.
Дополнительный вклад в тонкую структуру дает релятивистская поправка к кинетической энергии, возникающая благодаря высокой орбитальной скорости электрона. Этот эффект был впервые обнаружен Н.Бором и А.Зоммерфельдом, которые показали, что релятивистское изменение массы электрона должно вызывать прецессию его орбиты.
Учет спин-орбитального взаимодействия и релятивистской поправки к массе электрона дает следующее выражение для энергии тонкого расщепления уровней:
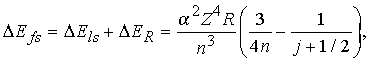
где = e2/ћc 1/137. Полный угловой момент электрона ![]() равен
равен ![]() + s. Для данного значения l квантовое число j принимает положительные значения j = l s (j = 1/2 для l = 0). Согласно спектроскопической номенклатуре состояние с квантовыми числами n, l, s, j обозначается как n2s + llj. Это значит, что 2p уровень водорода с n = 2 и j = 3/2 запишется в виде 22p3/2. Величина 2s + 1 называется мультиплетностью; она показывает число состояний, связанных с данным значением s. Заметим, что энергия расщепления уровня при данном n зависит только от j, но не от l или s в отдельности. Таким образом, согласно вышеприведенной формуле 22s1/2 и 22p1/2 уровни тонкой структуры вырождены по энергии. Подобным образом вырождены и уровни 32p3/2 и 32d3/2. Эти результаты согласуются с выводами теории Дирака, если пренебречь членами Z более высокого порядка. Разрешенные переходы определяются правилами отбора по j: j = 0, 1 (исключая j = 0 0).
+ s. Для данного значения l квантовое число j принимает положительные значения j = l s (j = 1/2 для l = 0). Согласно спектроскопической номенклатуре состояние с квантовыми числами n, l, s, j обозначается как n2s + llj. Это значит, что 2p уровень водорода с n = 2 и j = 3/2 запишется в виде 22p3/2. Величина 2s + 1 называется мультиплетностью; она показывает число состояний, связанных с данным значением s. Заметим, что энергия расщепления уровня при данном n зависит только от j, но не от l или s в отдельности. Таким образом, согласно вышеприведенной формуле 22s1/2 и 22p1/2 уровни тонкой структуры вырождены по энергии. Подобным образом вырождены и уровни 32p3/2 и 32d3/2. Эти результаты согласуются с выводами теории Дирака, если пренебречь членами Z более высокого порядка. Разрешенные переходы определяются правилами отбора по j: j = 0, 1 (исключая j = 0 0).
2. Структура и спектры молекул
Молекулярные спектры гораздо сложнее и разнообразнее атомных. Это обусловлено тем, что в молекулах имеются дополнительные степени свободы и наряду с движением электронов вокруг ядер атомов, образующих молекулу, происходят колебания самих ядер относительно равновесного положения, а также вращение молекулы как целого. Ядра в молекуле образуют линейную, плоскую или трехмерную конфигурацию. Плоская и трехмерная молекулы, состоящие из N атомов, обладают 3N–6 колебательными и тремя вращательными степенями свободы, а линейная – 3N–5 колебательными и двумя вращательными степенями свободы. Таким образом, молекула кроме электронной энергии имеет колебательную и вращательную внутренние энергии, а также новые системы уровней.
2.1 Вращательные спектры
Двухатомную молекулу можно упрощенно рассматривать как жесткий ротатор с моментом инерции I. Решение уравнения Шрёдингера для жесткого ротатора дает следующие разрешенные уровни энергии:
![]()
где J – квантовое число, характеризующее вращательный момент количества движения молекулы. Правило отбора для разрешенных переходов таково: DJ = ±1. Следовательно, чисто вращательный спектр состоит из ряда эквидистантных линий с частотами
![]()
Вращательные спектры многоатомных молекул имеют сходную структуру.
2.2 Колебательно-вращательные спектры
В действительности молекулярные связи не являются жесткими. В простейшем приближении движение ядер двухатомной молекулы можно рассматривать как колебания частиц с приведенной массой m относительно положения равновесия в потенциальной яме с гармоническим потенциалом. Если гармонический потенциал имеет вид V(x) = kx2/2, где x – отклонение межъядерного расстояния от равновесного, а k – коэффициент упругости, то решение уравнение Шрёдингера дает следующие возможные уровни энергии: Еv = hn (v+1/2). Здесь n – частота колебаний, определяемая формулой ![]() , а v – колебательное квантовое число, принимающее значения v = 1, 2, 3 ... . Правило отбора для разрешенных (инфракрасных) переходов: Dv = ±1. Таким образом, для колебательных переходов существует единственная частота n . Но поскольку в молекуле одновременно происходят колебания и вращение, возникает колебательно-вращательный спектр, в котором на колебательную частоту молекулы налагается «гребенка» вращательных линий.
, а v – колебательное квантовое число, принимающее значения v = 1, 2, 3 ... . Правило отбора для разрешенных (инфракрасных) переходов: Dv = ±1. Таким образом, для колебательных переходов существует единственная частота n . Но поскольку в молекуле одновременно происходят колебания и вращение, возникает колебательно-вращательный спектр, в котором на колебательную частоту молекулы налагается «гребенка» вращательных линий.
Похожие работы
... . Наконец, в последнее время произошел возврат к несканирующим приборам, в которых в качестве приемника излучения используется так называемая диодная матрица. Это тоже однолучевые приборы. Оптическая схема такого прибора представлена на следующем рисунке (Рис. 11). Продолжительность регистрации полного спектра во всем диапазоне не превышает 1 секунды. Особенностью спектров, получаемых на таких ...
... направленных спинов электронов (в печати недавно появилось сообщение о уникальном эксперименте по получению макроскопических порций атомарного водорода, неспособного соединяться в молекулы из-за того, что все атомы содержали электроны с одинаковым направлением спина). Механизм возникновения ковалентной связи в разнообразных химических соединениях аналогичен. Оптические спектры молекул более ...
... долей) исходных веществ. ► Стехиометрия – раздел химии, в котором рассматриваются массовые или объемные отношения между реагирующими веществами. Законы стехиометрии так же непреложны, как и любые другие естественнонаучные законы; кроме того, их знание очень полезно для прикладной химии, потому что позволяет количественно рассчитать выход химической реакции и необходимое количество исходных ...
... и химических систем; - проанализировать изучение структуры веществ в рамках химической системы. Рассмотрим подробнее концептуальные уровни в познании веществ и химические системы. Состав вещества и химические системы Химическая система – совокупность микро и макро количеств веществ, способных воздействием внешних факторов (условий) к превращениям с образованием новых химических соединений. ...


0 комментариев