Навигация
Электронные конфигурации для молекул
4. Электронные конфигурации для молекул
В упрощенной модели „соединенного" атома, мы имеем возможность приписать каждому электрону четыре квантовых числа: n — главное квантовое число, принимающее целые значения 0,1,...; l — азимутальное квантовое число, определяющее орбитальный момент электрона и принимающее значения 0, 1, …, n-1; λ — квантовое число, определяющее проекцию орбитального момента на ось молекулы и принимающее значения 0,1,…, l; наконец, спин электрона, равный +1/2 и -1/2. В случае атома электрон обозначается численным значением n и буквами s, p, d, f и т. д., указывающими соответственно на значения l = 0, 1, 2, 3, ... Продолжая формальную аналогию с атомом, электроны в молекулах при значениях λ = 0 1, 2, 3,... обозначают соответственно малыми греческими буквами ρ, π, δ и т. д. К этим квантовым числам снова применим принцип Паули. В молекулах мы имеем заполненные λ-или l-субоболочки, для которых результирующие орбитальный и спиновой моменты равны нулю. Соотношения между электронными конфигурациями соединенного атома и соответствующей молекулы приводятся ниже. Количество электронов в субоболочке по-прежнему обозначается числом, которое пишут сверху после других символов.
| Соединенный атом | 1s2 | 2s2 | 2p6 | 3s2 | 3p6 | 3d10 |
| Молекула | 1sσ2 | 2sσ2 | 2pσ22pπ4 | 3sσ2 | 3pσ23pπ4 | 3dσ23dπ43dδ4 |
Модель „соединенного" атома подвержена, однако, с многими ограничениями. Мэлликен рассмотрел различные возможные способы обозначения электронных конфигураций в молекулах. Часто желательно рассматривать внутренние электроны атомов, образующих молекулу, как остающиеся при своих атомах, а не как находящиеся на молекулярных орбитах. Тогда оказывается затруднительным приписать определенные главные квантовые числа внешним электронам. Мэлликен рассмотрел связывающие и разрыхляющие свойства молекулярных орбит различных типов и ввел в употребление буквы z, у, x, обозначающие электроны в порядке убывания их связывающих свойств.
5. Электрические и оптические свойства молекул
Поведение вещества в электрическом поле определяется основными электрическими характеристиками молекулы — постоянным дипольным моментом и поляризуемостью. Дипольный момент означает несовпадение центров тяжести положительных и отрицательных зарядов в молекуле, т. е. электрическую асимметрию молекулы Соответственно молекулы, имеющие центр симметрии, например H2, лишены постоянного дипольного момента; напротив, в HCl электроны смещены к атому Cl и дипольный момент равен 1,03 D (1,03×10-18 ед. СГС). Поляризуемостью характеризуется способность электронной оболочки любой молекулы смещаться под действием электрического поля, в результате чего в молекуле создаётся индуцированный дипольный момент. Значения дипольного момента и поляризуемости находят экспериментально с помощью измерений диэлектрической проницаемости. В случае аддитивности свойств молекул дипольный момент может быть представлен суммой дипольных моментов связей (с учётом их направления), то же относится к поляризуемости молекулы.
Оптические свойства вещества характеризуют его поведение в переменном электрическом поле световой волны — тем самым они определяются поляризуемостью молекулярного вещества. С поляризуемостью непосредственно связаны преломление и рассеяние света, оптическая активность и другие явления, изучаемые молекулярной оптикой.
6. Молекулы с одинаковыми ядрами
Молекулы с одинаковыми ядрами, например такие, как Н2, 03, N3, обладают дополнительными свойствами симметрии, существующими благодаря равенству зарядов обоих ядер. Поэтому возникает необходимость провести дальнейшее подразделение электронных состояний по следующему признаку: электронная волновая функция остается неизменной или меняет знак при отражении в центре симметрии. В первом случае состояния снабжаются индексом g, во втором случае—индексом u.
Любой энергетический уровень двухатомной молекулы является симметричным (s) или антисимметричным (а) в зависимости от того, остается неизменной или меняет знак полная волновая функция при перестановке обоих ядер. Можно показать, что для любого электронного состояния молекулы с одинаковыми ядрами все положительные уровни (+) являются симметричными (s), а все отрицательные (-) антисимметричными (а) или наоборот. Таким образом, симметрия a или s вращательных уровней оказывается снова чередующейся в зависимости от того, четным или нечетным является вращательное квантовое число К. Было найдено также, что состояния с симметрией a и s имеют различные статистические веса, причем отношения этих весов является функцией спина ядра. Поэтому чередующиеся вращательные уровни, а следовательно, и чередующиеся линии в ветвях полос обнаруживают чередующиеся интенсивности. Так, например, в случае азота со спином ядра, равным единице (N14), линии чередуются с отношением интенсивностей 1:2, тогда как для водорода со спином ядра, равным 1/2, это отношение равно 1:3. При спине ядра, равном нулю, как в 02 и Не3, имеется один ряд уровней со статистическим весом, равным нулю. В этом случае чередующиеся линии в ветвях полностью отсутствуют.
Заключение
Электрические, оптические, магнитные и другие свойства молекулы в конечном счёте связаны с волновыми функциями и энергиями различных состояний молекул; через них выражаются и электрический дипольный момент, и магнитный момент, и поляризуемость, и магнитная восприимчивость. Прямую информацию о состояниях молекулы и вероятностях перехода между ними дают молекулярные спектры.
Частоты в спектрах, соответствующих вращательным переходам, зависят от моментов инерции молекулы, определение которых из спектроскопических данных позволяет получить наиболее точные значения межатомных расстояний.
Общее число линий или полос в колебательном спектре молекулы зависит от её симметрии. Частоты колебаний, наблюдаемые в спектрах, определяются, с одной стороны, массами атомов и их расположением, с другой — динамикой межатомных взаимодействий. Теория колебаний многоатомных молекул соответственно опирается на теорию химического строения и классическую механику связанных колебаний. Исследование колебательных спектров позволяет сделать ряд выводов о строении М., о межатомных и межмолекулярных взаимодействиях, изучать явления таутомерии, поворотной изомерии.
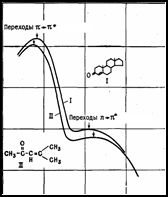
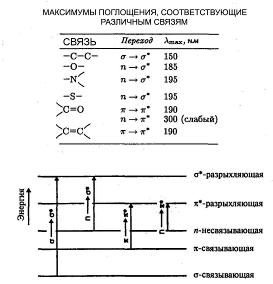
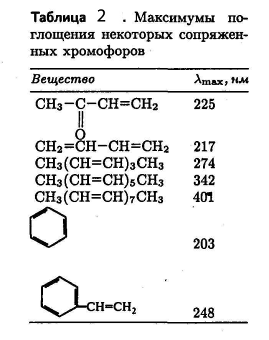
Электронные переходы в молекуле характеризуют структуру их электронных оболочек, состояние химических связей. Спектры молекул, обладающих большим числом сопряжённых связей, характеризуются длинноволновыми полосами поглощения, попадающими в видимую область. Изучение электронно-колебательных спектров молекулы необходимо для понимания естественной и магнитной оптической активности.
Литература
1. Зайдель А.Н., Островская Г.В., Островский Ю.И. Техника и практика спектроскопии. М., 1972
2. Гейдон А.И. Энергия диссоциации и спектры двухатомных молекул
3. Герцберг, Герхард. Спектры и строение двухатомных молекул – New York, 1915.
4. Летохов В.С., Чеботарев В.П. Принципы нелинейной лазерной спектроскопии. М., 1975
5. Собелман И.И. Введение в теорию атомных спектров – ФМГ, 1967.
6. Фрим С.Э. Оптические спектры атомов – ФМГ, 1963.
7. http://gatchina3000.ru/great-soviet-encyclopedia.
Похожие работы
... . Наконец, в последнее время произошел возврат к несканирующим приборам, в которых в качестве приемника излучения используется так называемая диодная матрица. Это тоже однолучевые приборы. Оптическая схема такого прибора представлена на следующем рисунке (Рис. 11). Продолжительность регистрации полного спектра во всем диапазоне не превышает 1 секунды. Особенностью спектров, получаемых на таких ...
... направленных спинов электронов (в печати недавно появилось сообщение о уникальном эксперименте по получению макроскопических порций атомарного водорода, неспособного соединяться в молекулы из-за того, что все атомы содержали электроны с одинаковым направлением спина). Механизм возникновения ковалентной связи в разнообразных химических соединениях аналогичен. Оптические спектры молекул более ...
... долей) исходных веществ. ► Стехиометрия – раздел химии, в котором рассматриваются массовые или объемные отношения между реагирующими веществами. Законы стехиометрии так же непреложны, как и любые другие естественнонаучные законы; кроме того, их знание очень полезно для прикладной химии, потому что позволяет количественно рассчитать выход химической реакции и необходимое количество исходных ...
... и химических систем; - проанализировать изучение структуры веществ в рамках химической системы. Рассмотрим подробнее концептуальные уровни в познании веществ и химические системы. Состав вещества и химические системы Химическая система – совокупность микро и макро количеств веществ, способных воздействием внешних факторов (условий) к превращениям с образованием новых химических соединений. ...


0 комментариев