Навигация
1. Протеинкиназы А
Протеинкиназы А (цАМФ-стимулируемые) участвуют в аденилатциклазной системе передачи сигнала. Протеинкиназа А состоит из 4 субъединиц R2C2 - двух регуляторных субъединиц (R2) и двух каталитических (C2). Комплекс R2C2 не обладает ферментативной активностью.
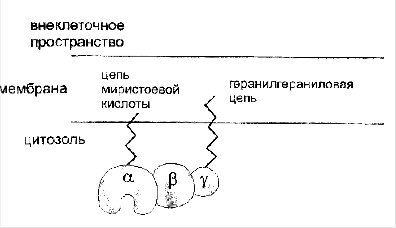
Комплекс R2C2 разными способами прикрепляется к мембране. Некоторые формы протеинкиназы А "заякориваются" с помощью алифатического остатка миристиновой кислоты каталитических субъединиц. Во многих тканях протеинкиназа А связана с "заякоренным" белком АКАРs (от англ. сАМР - dependent protein kinase anchoring proteins). АКАРs имеет центр связывания для регуляторных субъединиц протеинкиназы А. С помощью белка АКАРs протеинкиназа А связывается с мембраной в области локализации ферментов, катализирующих образование цАМФ (аденилатциклаза) или его гидролиз (фосфодиэстераза), а также белков, в регуляции активности которых фермент принимает участие, например потенциалзависимые Са2+-каналы.
Регуляторные субъединицы протеинкиназы А имеют специфические центры для связывания цАМФ. Присоединение цАМФ к регуляторным субъединицам приводит к изменению конформации последних и снижению сродства каталитическим субъединицам С, происходит диссоциация по схеме:
цАМФ4 + R2C2 = цАМФ4R2 + С + С
Субъединицы С представляют собой активную форму протеинкиназы А, которая катализирует реакции фосфорилирования белков по серину и треонину. Каталитические субъединицы С у разных типов протеинкиназ А не идентичны, они различаются прежде всего специфичностью в отношении белков-субстратов.
2. Протеинкиназы С
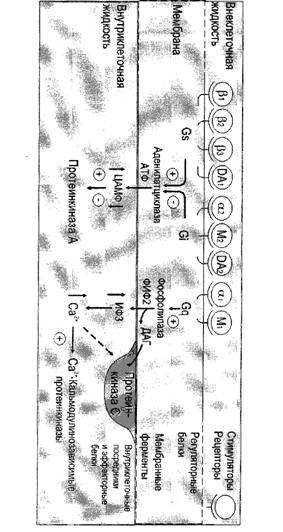
Протеинкиназы С участвуют в инозитолфосфатной системе передачи сигнала. Фермент состоит из двух функционально различных доменов - регуляторного и каталитическоо. Регуляторный домен содержит 2 структуры ("цинковые пальцы"), образованные фрагментами пептидной цепи, богатыми цистеином, и содержащими два иона цинка. "Цинковые пальцы" участвуют в связывании: диацилглицерола. Другой фрагмент регуляторного домена имеет высокое сродство к Са2+. Повышение концентрации кальция в цитозоле увеличивает сродство протеинкиназы С к фосфатидилсерину мембраны. Транслокация протеинкиназы С к мембране позволяет ферменту связаться с ДАГ, который ещё больше повышает сродство протеинкиназы С к ионам кальция. Наиболее распространённые изоформы протеинкиназы С активируются Са2+, диацилглицеролом и фосфатидилсерином.
Каталитический домен имеет центр, связывающий АТФ и белок-субстрат. Активная форма фермента протеинкиназы С фосфорилирует белки по остаткам серина и треонина. Снижение концентрации ионов кальция в клетке нарушает связь протеинкиназы С с фосфатидилсерином и диацилглицеролом, фермент переходит в неактивную форму и отделяется от мембраны.
3. Протеинкиназы G
В отличие от протеинкиназы А, протеинкиназа G присутствует не во всех тканях, её обнаруживают в лёгких, мозжечке, гладких мышцах и тромбоцитах. Изоформы протеинкиназы G могут быть связаны с мембраной или находиться в цитоплазме. Растворимая протеинкиназа G состоит из двух идентичных субъединиц, каждая из которых имеет два центра для связьвания цГМФ. Присоединение цГМФ к регуляторным центрам вызывает конформационные изменения субъединиц и повышает каталитическую активность фермента. Протеинкиназа G, подобно протеинкиназе А и С, специфична в отношении определенных белковых субстратов, которые она фосфорилирует по остаткам серина и треонина.
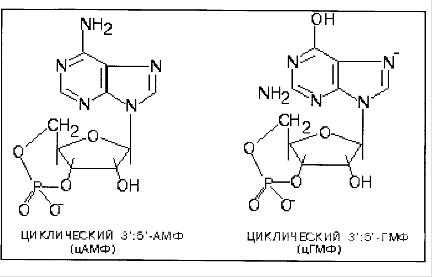
ФосфодиэстеразыФосфодиэстеразы - ферменты, катализирующие превращение цАМФ или цГМФ в неактивные метаболиты АМФ или ГМФ. Фосфодиэстеразы, снижая концентрации вторичных посредников, разрывают цепь превращений, вызванных активатором рецептора.
Фосфодиэстеразы присутствуют в клетках тканей в 2 формах: в форме растворимого белка и мембранносвязанного. Формы фермента, связанные с мембраной, в разных тканях составляют 5-40%. В одной и той же ткани могут присутствовать разные формы фосфодиэстеразы, различающиеся по сродству к субстратам, молекулярному весу, заряду, регуляторным свойствам и локализации в клетке.
Фосфодиэстеразы циклических нуклеотидов не обладают абсолютной специфичностью, поэтому, как правило, одна и та же форма фермента способна гидролизовагь как цАМФ, так и цГМф. Однако скорости гидролиза этих двух нуклеотидов под действием одной и той же фосфодиэстеразы могут значительно различаться. Это зависит от того, какая фосфодиэстераза присутствует в клетке - более специфичная в отношении цАМФ или более специфичная к цГМФ, от соотношения концентраций цАМФ и цГМФ в клетке и от действия регуляторов фосфодиэстеразы.
В большинстве тканей присутствует фосфодиэстераза - 1, более специфичная к цАМФ, активируемая Са2+, комплексом 4Са2+-кальмодулин и цГМФ.
Аденилатциклазная системаПри участии аденилатциклазной системы реализуются эффекты сотни
различных по своей природе сигнальных молекул гормонов, нейромедиаторов, эйкозаноидов.
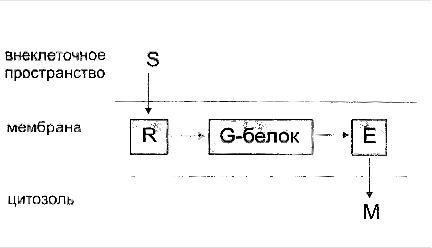
Функционирование системы трансмембранной передачи сигналов обеспечивают белки: Rs-рецептор сигнальной молекулы, которая активирует аденилатциклазу, и Ri-рецептор сигнальной молекулы, которая ингибирует аденилатциклазу; Gs-стимулирующий и Gi-ингибирующий аденилатциклазу белки; ферменты аденилатциклаза (АЦ) и протеинкиназа А (ПКА).
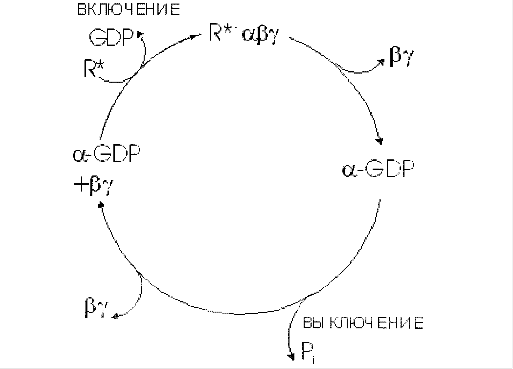
Последовательность событий, приводящих к активации аденилатциклазы:
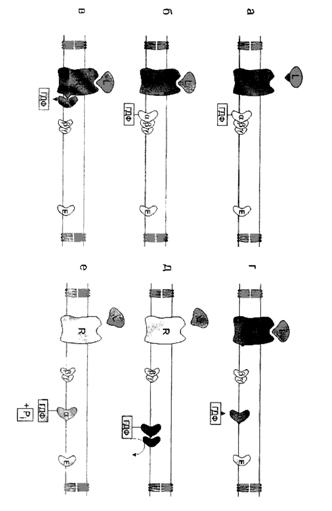
связывание активатора аденилатциклазной системы, например гормона (Г) с рецептором Rs, приводит к изменению конформации рецептора и увеличению его сродства к Gs-белку. В результате образуется комплекс [Г] [R] [G-ГДФ] ;
присоединение [Г] [R] к G-ГДФ снижает сродство α-субъединицы Gs-белка к ГДФ и увеличивает сродство к ГТФ. ГДФ замещается на ГТФ;
это вызывает диссоциацию комплекса. Отделившаяся субъединица α, связанная с молекулой ГТФ, обладает сродством к аденилатциклазе:
[Г] [R] [G-ГТФ] = [Г] [R] + α-ГТФ + βγ
взаимодействие α-субъединицы с аденилатциклазой приводит к изменению конформации фермента и его активации, увеличивается скорость образования цАМФ из АТФ;
конформационные изменения в комплексе [α-ГГФ] [АЦ] стимулируют повышение ГТФ-фосфатазной активности α-субъединицы. Протекает реакция дефосфорилирования ГТФ, и один из продуктов реакции - неорганический фосфат (Р) отделяется от α-субъединицы, а комплекс [α-ГДФ] сохраняется; скорость гидролиза определяет проведения сигнала;
образование в активном центре α-субъединицы молекулы ГДФ снижает его сродство к аденилатциклазе, но увеличивает сродство к βγ-субъединицам. Gs-белок возвращается к неактивной форме;
если рецептор связан с активатором, например гормоном, цикл функционирования Gs-белка повторяется. Активация протеинкиназы А (ПКА)
молекулы цАМФ могут обратимо соединяться с регуляторными субъединицами ПКА
присоединение цАМФ к регуляторным субъединицам (R) вызывает диссоциацию комплекса С2R2 на комплекс цАМФ4R2 и С + С
активная протеинкиназа А фосфорилирует специфические белки по серину и треонину, в результате изменяются конформация и активность фосфорилированных белков, что приводит к изменению скорости и направления регулируемых ими процессов в клетке.
концентрация цАМФ в клетке может регулироваться, она зависит от соотношения активностей ферментов аденилатциклазы и фосфодиэстеразы.
Большую роль в регуляции внутриклеточной сигнальной системы играет белок АКАРs. "Заякоренный" белок АКАРs участвует в сборке ферментных комплексов, включающих не только протеинкиназу А, но и фосфодиэстеразу и фосфопротеинфосфатазу.
Каскадный механизм усиления и подавления сигнала. Передача сигнала от мембранного рецептора через G-белок на фермент аденилатциклазу служит примером каскадной системы усиления этого сигнала. Одна молекула, активирующая рецептор, может "включать" несколько G-белков и затем каждый активирует несколько молекул аденилатциклазы с образованием тысяч молекул цАМФ. На этом этапе сигнал усиливается в 10²-10³ раз. Образующийся цАМФ "включают" другой фермент - протеинкиназу А, усиливая сигнал ещё в 1000 раз. Фосфорилирование ферментов протеинкиназой. А ещё больше усиливает сигнал, в результате суммарное усиление равно 106-107 раз. Таким образом, по механизму каскадного усиления одна молекула регулятора способна изменить активность миллионов других молекул.
Но для любой из систем трансмембранной передачи сигнала клетка имеет другую систему, подавляющую этот сигнал. Каждый из этапов в ферментном каскаде находится под контролем специальных подавляющих этот сигнал механизмов. Например, длительное действие гормона приводит к десенсибилизации мембранных рецепторов: они либо инактивируются, либо вместе с гормоном погружаются в клетку посредством эндоцитоза. В результате десенсибилизации рецепторов степень активации аденилатциклазной системы снижается. Если в клетке длительное время повышена концентрация цАМФ (повышена активность протеинкиназы А), может происходить фосфорилирование кальциевых каналов, что приводит к повышению концентрации Са²+ в клетке. Калций активирует Са²+-зависимую фосфодиэстеразу, катализирующую превращение цАМФ в АМФ. В результате инактивации протеинкиназы А (R2С2) снижается скорость фосфорилирования специфических ферментов. Завершает "выключение" системы фосфопротеинфосфатаза, дефосфорилирующая фосфопротеины.
Влияние бактериальных токсинов на активность аденилатциклазы (АДФ-рибозилирование G-белков)Для изучения функционирования G-белков аденилатциклазной системы были использованы экзогенные бактериальные яды холерный и коклюшный токсины. Токсины в экспериментальных условиях повышают активность аденилатциклазы практически во всех клетках организма; так, холерный токсин может стимулировать секрецию тиреоидных гормонов клетками щитовидной железы, стероидных гормонов клетками надпочечников, распад жиров в жировых клетках. Реакция разных клеток на холерный токсин вызвана повышением уровня цАМФ в этих клетках.
Холерный токсин - олигомерный белок. Одна из субъединиц фермент АДФ-рибозилтрансфераза; проникая в клетку, она катализирует присоединение АДФ-рибозы к αs-субъединице комплекса [αs - ГТФ] [АЦ] (этап активации аденилатциклазы).
NAD+ + [αs, - ГТФ] [АЦ] - [АДФ - рибозил - αs ГТФ] [АЦ] +никотинамид + Н+
АДФ-рибозилирование ингибирует проявление ГТФ-фосфатазной активности αs - субъединицы, не происходит дефосфорилированние ГТФ. Цикл функционирования G-белка останавливается на этапе активации фермента аденилатциклазы, отвечающего за образование цАМФ из АТФ. Фермент аденилатциклаза сохраняет повышенную активность в течение длительного времени.
Субъединица коклюшного токсина, проникая в клетку, катализирует АДФ-рибозилирование αi-субъединицы активированного Gi-белка(αi βγ-ГТФ).
NAD+ [αi βγ-ГТФ] - [АДФ-рибозил-αi βγ-ГТФ] + никотинамид + Н+
Модифицированная αi - субъединица сохраняет высокое сродство к βγ - субъединицам, те. Gi-белок теряет способность диссоциировать на αi - ГТФ и βγ-субъединицы. Таким образом, ингибирующий сигнал (αi-ГТФ) не достигает аденилатциклазы, значит в этом случае возможна только её активация при связывании с αs-ГТФ. Действие коклюшного токсина на клетки тканей всегда приводит к повышению уровня цАМФ.
Симптомы холеры и коклюша развиваются в результате действия токсинов, вырабатываемых соответствующими микроорганизмами.
Инозитолфосфатная системаФункционирование инозитолфосфатной системы трансмембранной передачи сигнала обеспечивают: R (рецептор), фосфолипаза С, Gрlс - белок, активирующий фосфолипазу С, белки и ферменты мембран и цитозоля.
Последовательность событий, приводящих к активации фосфолипазы С:
связывание сигнальной молекулы, например гормона с рецептором (R) вызывает изменение конформации и увеличение сродства к Gplc-белку.
образование комплекса [Г] [R] [Gрlс ГДФ] приводит к снижению сродства α-протомера G рlс белка к ГДФ и увеличению сродства к ГТФ. ГДФ заменяется на ГТФ.
это вызывает диссоциацию комплекса; отделившаяся α-субъединица, связанная с молекулой ГТФ, приобретает сродство к фосфолипазе С.
α-ГТФ взаимодействует с фосфолипазой С и активирует её. Под действием фосфолипазы С происходит гидролиз липида мембраны фосфатидилинозитол-4,5 - биофосфата (ФИФ2).
в ходе гидролиза образуется и выходит в цитозоль гидрофильное вещество инозитол-1,4,5-трифосфат (ИФ3). Другой продукт реакции диацилглицерол (ДАГ) остаётся в мембране и участвует в активации фермента протеинкиназы С (ПКС).
инозитол-1,4,5-трифосфат (ИФ3) связывается специфическими центрами Са2 - канала мембраны ЭР, это приводит к изменению конформации белка и открытию канала - Са²+ поступает в цитозоль. В отсутствие в цитозоле ИФ3 канал закрыт.
Активация протеинкиназы С.
• Повышение концентрации Са²+ в цитозоле клетки увеличивает скорость
взаимодействия Са²+ с неактивным цитозольным ферментом протеинкиназой С(ПКС) и белком кальмодулином, таким образом сигнал, принятый рецептором клетки, раздваивается.
• Связывание протеинкиназы С с ионами кальция позволяет ферменту вступать в кальций-опосредованное взаимодействие с молекулами "кислого" фосфолипида мембраны, фосфатидилсерина (ФС). Диацилглицерол, занимая специфические центры в протеинкиназе С, ещё более увеличивает её сродство к ионам кальция.
• На внутренней стороне мембраны образуется ферментативный комплекс - [ПКС] [Са²+] [ДАГ] [ФС] - активная протеинкиназа С, фосфорилирующая специфические ферменты по серину и треонину.
Участие белка кальмодулина в инозитолфосфатной передаче сигналаВ клетках многих тканей присутствует белок кальмодулин, который функционирует как внутриклеточный рецептор Са²+, он имеет 4 центра для связывания Са²+. Комплекс [кальмодулин] - [4Са²+] не обладает ферментативной активностью, но взаимодействие комплекса с различными белками и ферментами приводит к их активации.
Саморегуляция системы
Как и большинство систем трансмембранной передачи сигналов, инозитолфосфатная система имеет не только механизм усиления, но и механизм подавления сигнала. Присутствующие в цитозоле инозитол-1,4,5-трифосфат ((ИФ3) и диацилглицерол (ДАГ) в мембране могут в результате серии реакций опять превращаться в фосфатидилинозитол-4,5-бисфосфат (ФИФ2). Ферменты, катализирующие восстановление фосфолипида, активируются фосфорилированием протеинкиназой С.
Концентрация Са²+ в клетке снижается до исходного уровня при действии Са²+-АТФ-аз цитоплазматической мембраны и ЭР, а также Na+/Са²+-и Н+/Са²+-транслоказ (активный антипорт) клеточной и митохондриальной мембран.
Функционирование транслоказ Са²+ и Са²+-АТФ-аз может активироваться:
комплексом [камьмодулин] [4 Са] ;
протеинкиназой А (фосфорилированием);
протеинкиназой С (фосфорилированием). Понижение концентрации Са2 в клетке и диацилглицерола в мембране приводит к изменению конформации протеинкиiiазы С, снижению её сродства к фосфатидилсерину, фермеiтт диссоциирует в цитозоль (неактивная форма).
Фосфорилированные протеинкиназой С ферменты и белки под действием фосфопротеинфосфатазы переходят в дефосфорилированную форму.
α-субъединица: общие свойстваα-субъединица играет главную роль в функционировании G-белков. Она связывает ГТФ. Она обратимо взаимодействует с β и γ субъединицами, присоединяясь к ним, когда в центре находится ГДФ и диссоциируя, когда в центре ГТФ. При связывании ГТФ α субъединица активируется и приобретает способность регулировать эффекторные системы внутриклеточные. α субъединицы части G-белков могут подвергаться химическим модификациям. Под воздействием холерного и коклюшного токсинов происходит ФДФ-риболизирование белков по аргининовому и цистеиновому остатку на С-конце, в результате чего нарушается нормальное функционирование G-белков.
Кроме того, протеинкиназа С может фосфорилировать α-субъединицу очищенного G-белка, а in vivо белка Gz. По-видимому белки при этом инактивируются.
Большинство G-белков имеет α-субъединицы с молекулярным весом около 40 Кд.
β и γ субъединицы: общая характеристикаБета и гамма субъединицы образуют комплекс друг с другом, распадающийся только в денатурирующих условиях. До конца их роль не ясна. В экспериментах с трансдуцином, а затем с белком Gi было показано, что субъединицы бета и гамма необходимы для взаимодействия G-белка с рецептором и замещения ГДФ на ГТФ.
Бета-гамма комплекс прочно связан с мембраной и служит якорем для α-субъединицы. При отделении α-субъединицы бета-гамма комплекс может переходить в цитоплазму.
Кроме связывания и ингибирования активности α-субъединицы бета - гамма комплекс в некоторых случаях оказывает прямое воздействие на эффекторные системы клетки. Он активирует фосфолипазу А2, взаимодействует с кальмодулином благодаря чему ингибирует активность аденилатциклазы мозга. G-бета-гамма комплекс ингибирует стимуляцию
АС1 по средством Gs-альфа.
АС2 стимулируется связыванием G-бета-гамма, но только в присутствии Gs - альфа.
АС3 также стимулируется G-бета-гамма. Калиевые каналы сердца открываются при связывании Gs-альфа и G-бета-гамма. Мембрана клеточная: стимуляция гидролиза фосфолипидов. Мембрана клеточная: изменение содержания цАМФ.
G-белки: βγ-субъединицыФосфорилирование рецепторов является одним из механизмов регуляции их активности. βγ-субъединицы G-белков могут осуществлять отрицательную обратную связь, активируя протеинкиназы, которые фосфорилируют рецепторы. Эти протеинкиназы называются GRК. К GRК протеинкиназам относятся родопсинкиназа и β-адренергическая киназа. Фосфорилирование приводит к удалению рецептора киназа. Например, мускариновые и адренорецепторы, фосфорилированные по серину и треонину на С-концевом домене, становятся мишенью для связывания арристина, что подготавливает их для удаления эндоцитозом. Обычно на С-конце рецептора есть несколько участков для фосфорилирования различными протеинкиназами. Известно, что слабый стимул (низкая концентрация агониста) активирует протеинкиназу А, а сильный стимул активирует b-АRК протеинкиназу, которая, фосфорилируя рецептор, прерывает передачу сигнала на аденилатциклазу и прекращает производство сАМР. Фосфорилирование, осуществляемое протеинкиназой А происходит тогда, когда занято 10% рецепторов. При этом фосфорилирование уже других, не занятых, рецепторов приводит к освобождению βγ-субъединиц и соответствующему фосфорилированию другой протеинкиназой b-АRК.
βγ-субъединицьт обеспечивают локализацию, эффективное связывание и дезактивацию α-субъединиц, регулируют сродство рецепторов к их активирующим лигандам, понижают способность GDР к диссоциации от субъединицы (стабилизация инактивированного состояния), открывает мускариновый К+-канал в сердце, закрывают Са2+ - канал в пресинаптической мембране, активируют фосфолипазу РLА2 и некоторые изоформы фосфолипазы С, регулируют сродство рецептора к агонисту.
ГТФ (GТР) - связывающие белки.
Передача сигналов от рецепторов, на внутриклеточные эффекторные системы осуществляется с помощью ГТФ-связывающих белков. ГТФ-связывающие белки активируются \ дезактивируются с помощью специального механизма - ГТФ-фазного цикла.
ГТФ-связывающие белки образуют два основных семейства G-белков и низкомолекулярных ГТФ-связывающих белковВсе эти белки сильно связывают ГТФ и превращают его в ГДФ, при этом происходит переход белка из активированного в неактивное состояние. Свойства ГТФ-связывающих белков. Основной структурной особенностью ГТФ-связывающих белков является наличие домена связывания гуаниновых нуклеотидов. Наличие соответствующих консенсусных аминокислотных последовательностей является однозначным указанием на принадлежность белка к данному семейству.
Литература
1. Биохимия.3-е издание (исправленное). М; Издательская группа ГЭОТАР-Медиа. 2006г.
2. Основы биохимии. А. Уайт, Ф Хендлер, Э. Смит, Р. Хилл, И. Леман.3 т. М; Мир1981 г.
3. Биохимия. Марри, Греннер. М; Высшая школа. 1993г.
4. Биохимия. Ленинджер, 1995г.
5. Биохимия. В.П. Комов., В.Н. Шведова. Дрофа; М: 2004г. .
6. Общая биохимия. Учебное пособие по биохимии. Курс лекций. М.Т. Генгин; 1997г.
7. Основы биохимии. Ю.Б. Филиппович. Издание второе, переработанное и дополненное. Высшая школа; М4, 1995г.
Похожие работы
... , вызывает уменьшение количества синтезируемых ферментов. Это последнее явление получило название репрессии синтеза ферментов. Оба явления — индукция и репрессия — взаимосвязаны. Согласно теории Жакоба и Моно в биосинтезе белка у бактерий участвуют по крайней мере три типа генов: структурные гены, ген-регулятор и ген-оператор. Структурные гены определяют первичную структуру синтезируемого белка. ...
... белка - в различных сортах мяса и птицы содержится от 14 до 24% белка. Взаимозаменяемость первой и второй группы. Продукты двух первых групп являются наиболее важными поставщиками полноценного белка, с близкими по их аминокислотному составу и хорошей усвояемости организмом. Продукты первой и второй группы как источники белка в значительной степени могут заменять друг друга. Это означает, что их ...
... + щелочная ср. NH2 R R R COOH COO – COO – Катион Амфион Анион Таким образом, фактором, определяющим поведение белка как катиона или аниона, является реакция среды, которая определяется концентрацией водородных ионов и выражается величиной рН. Однако ...
... равен 1/16 массы атома кислорода (кислородная единица массы). КОНФИГУРАЦИЯ И КОНФОРМАЦИЯ БЕЛКОВОЙ МОЛЕКУЛЫ Из всего сказанного можно заключить, что пространственная организация белков очень сложна. В химии существует понятие - пространственная КОНФИГУРАЦИЯ - жестко закрепленное ковалентными связями пространственное взаимное расположение частей молекулы (например: принадлежность к L-ряду ...


0 комментариев