Навигация
СЕКРЕТИРУЕМЫЕ РЕГУЛЯТОРНЫЕ И ТРАНСПОРТНЫЕ НЕЙРОСПЕЦИФИЧЕСКИЕ БЕЛКИ
5. СЕКРЕТИРУЕМЫЕ РЕГУЛЯТОРНЫЕ И ТРАНСПОРТНЫЕ НЕЙРОСПЕЦИФИЧЕСКИЕ БЕЛКИ
Особо необходимо остановиться на секретируемых белках, выполняющих функцию транспорта и защиты от разрушения пептидных регуляторов, вырабатываемых ЦНС. Из них наиболее изучены нейрофизины, локализованные преимущественно в задней доле гипофиза и гипоталамуса. Они представляют собой гетерогенную группу низкомолекулярных кислых белков. Нейрофизины головного мозга человека и ряда животных достаточно хорошо исследованы. Выделены три фракции этих нейроспецифических белков – НФ1, НФН, НФШ, а также четыре минорные фракции. Суммарная фракция НФ имеет молекулярную массу около 10 кД. Содержание НФ в задней доле гипофиза относительно очень велико и составляет у крыс в среднем 0,15 нМ, а в гипоталамусе 0.01 нМ. В небольших количествах НФ обнаружены также в плазме крови.
Пептидная цепь НФ состоит из 91–95 а.о. Интересно, что 85–90% аминокислотных остатков в составе нейрофизинов идентичны у человека и исследованных видов животных. Иммуно-химическими методами установлено, что фракция НФ1 синтезируется в паравентрикулярных ядрах, а НФИ – а супраоптическом ядре.
В интактном состоянии нейрофизины находятся в прочном комплексе с окситоцином или вазопрессином. Связь НФ с этими гипофизарными гормонами нековалентная и осуществляется фрагментом молекулы, находящимся в пределах 37–54‑го аминокислотных остатков полипептидной цепи НФ. В нормальных условиях существует определенное молярное соотношение между НФ и гипофизарными гормонами. Так, в гипофизе это соотношение между НФ и окситоцином равно 1:10, а в гипоталамусе – 1:14.
Применение метода ЯМР позволило показать, что происходит очень быстрый обмен между комплексами НФ-окситоцин или НФ-вазопрессин и свободным гормоном.
В последнее пятилетие обнаружено, что нейрофизины отнюдь не являются единственными представителями белков-носителей пептидных регуляторов. Установлено существование разнообразных по структуре белков, которые находятся в тесной, но нековалентной связи с опиоидными пептидами, корти-колиберином, тафцином и др., защищая их от расщепления протеазами в жидкостях организма.
На примере гликопротеинов симпатических нейронов в культуре показана возможность их секретирования #в среду после ряда модифлкаций как белковой, так и углеводной части молекул. Содержащие маннозу и несиалированные гликопротеины PI и РЗ после сиалирования и включения в плазматическую мембрану модифицируются в гликопротеины В1 и ВЗ, которые в ходе дальнейших модификаций превращаются, соответственно, в гликопротеины В2 и В4 а затем секретируются в форме растворимых производных S2 и S4. Процессы модификации гликопротеинов ускоряются при выбросе медиаторов. Производные гликопротеина В1 иммунологически идентичны большому поверхностному гликопротеину различных типов нейронов центральной и периферической нервной системы, увеличение концентрации которого индуцируется фактором роста нервов.
К секретируемым белкам относятся и некоторые из эпендименов – а, р и у. Нейроспецифичны только р и у. Они обнаружены в мозге рыб, амфибий, крыс. Под действием специфической протеазы эпендимин р превращается в эпендимин у и секретируется из нейронов. В опытах с золотыми рыбками показано, что этот процесс усиливается при адаптации рыб к новым условиям плавания, что позволило предположить участие эпендиминов в механизмах формирования долговременной памяти.
Приводя примеры регуляторных белков нервной ткани, следует особо остановиться на нейротрофинах. Нейротрофины определяются вообще как факторы, стимулирующие дифференциацию нейронов, поддерживающие их выживание, индуцирующие рост дендритов и аксонов в направлении клеток-мишеней. Перечисленные процессы управляются большим числом факторов различной природы. Однако среди них важную роль играют интенсивно изучаемые белковые соединения. Прежде всего – семейство белков – факторов роста и трофики нервов. Отнесение их к категории нейроспецифических белков не безоговорочно: их содержание велико, например, в слюнной железе самца мыши, ядах некоторых змей и в некоторых других периферических тканях. Тем не менее, их содержание и функции в нервной ткани настолько специфичны, что они требуют краткого рассмотрения.
К настоящему времени наиболее изучены три нейротрофина, близких друг другу по структуре: NGF, BDNF и NT‑3. Они представляют собой относительно небольшие белки. В частности, минимальная по размеру активная форма NGF состоит из двух субъединиц по 13.25 кД. Различные нейротрофины имеют определенную специализацию: NGF
– «опекает» нейроны периферических симпатических ганглиев, а также холинергические нейроны переднего мозга, BDNF
– часть моторных и сенсорных нейронов, a NT‑3 – нейроны гиппокампа. Трофическая функция и стимуляция роста аксонов нейротрофинами имеют особое значение в онтогенезе, при повреждениях ЦНС, а также в некоторых критических состояниях, например при эпилептических судорогах. В онтогенезе мозга достижение тем или иным аксоном клетки-мишени ведет к ретроградному сигналу, осуществляемому нейротрофином, который обеспечивает выживание соответствующего нейрона, Нейроны, аксоны которых не достигают мишени, погибают.
Нейросекреторные гранулы гипоталамуса продуцируют ряд гликопротеинов, выполняющих специфические регуляторные функции. А.А. Галояном и сотр. в 1971г. выделены и далее всесторонне исследованы гликопротеины, являющиеся коронаррасширяющими и коронарсуживающими гормоиоподобиыми факторами с молекулярным весом около 20–30 кД. Они не имеют строгой мозговой специфичности: в небольших количествах они обнаружены в сердце, скелетных мышцах, надпочечниках, печени.
В гипоталамусе вырабатывается и секретируется также ряд относительно низкомолекулярных пептидных регуляторов – так называемых рилизинг-гормонов. Нейропептиды имеют в качестве предшественников пептиды, которые по размерам следует относить к белкам, – так называемые протопептиды с Мг 20–50 кД. Многие из них гликозилированы.
Белок поверхности нейронов р-АРР также является источником белка-регулятора. Отщепляемая внешняя часть белка выходит в межклеточную жидкость и индуцирует образование новых отростков и нервных окончаний, участвуя в формировании памяти. При болезни Альцгеймера этот процесс искажается.
Похожие работы
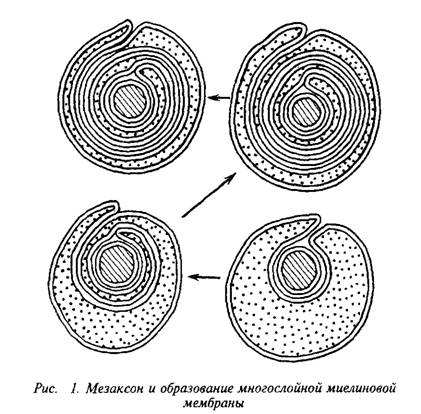
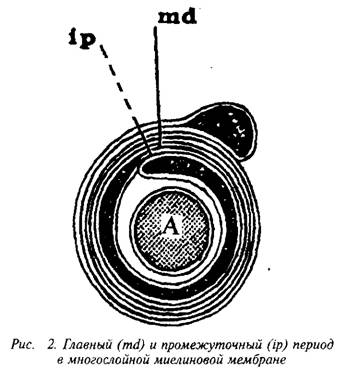
... и инозитолтрифосфат подвергаются химическим превращениям, требующим АТФ и ЦТФ и приводящим к восстановлению три-фосфоинозитида. Таким образом, цикл замыкается и уровень полифосфоинозитидов в мембране восстанавливается. 7. МИЕЛИН В ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЕ Мозг человека содержит 120 г миелина, что составляет одну треть его сухой массы. Миелин – уникальное образование, организация которого ...
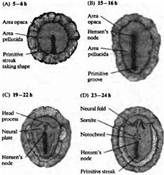
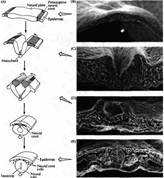
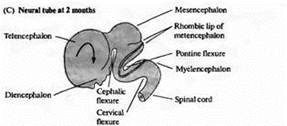
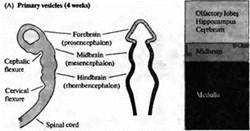
... уровне направленные мутации, что открывает дорогу к обнаружению важных генов позвоночных, которые могут иметь гомологов у некоторых видов более просто устроенных беспозвоночных. Развитие нервной системы в раннем периоде В раннем периоде морфогенеза позвоночных область гаструлы, из которой в дальнейшем формируется нервная система, представляет собой простую полоску эктодермы (рис. 1). ...
... видов животных. Региональные различия в концентрации метионина невелики. Влияние диеты на концентрацию метионина в мозге также незначительно из-за конкурентных отношений с нейтральными аминокислотами за транспортные системы. Метионин в пуле свободных аминокислот утилизируется на 80% для синтеза белка. Метаболизм свободного метионина до цистеина начинается с образования S-аденозилметионина, ...
... в синапсах вызывают деполяризацию или гиперполяризацию постсинаптической клетки. Потенциалы действия, представляющие собой короткие деполяризационные сигналы большой амплитуды, проводят по отросткам нейрона информацию из одного отдела нервной системы в другой. Все эти изменения мембранного потенциала вызваны движением ионов через клеточную мембрану. Например, направленное внутрь клетки движение ...
0 комментариев