Навигация
Сборка мультисубъединичных комплексов и обновление
5. Сборка мультисубъединичных комплексов и обновление
мембранных белков
После встраивания мембранного полипептида в мембрану он еще должен приобрести правильную конформацию, обеспечивающую его биологическую активность, а если речь идет о мультисубъединичных комплексах, то связаться с другими белками. В частности, у эукариот при этом должны произойти различные ковалентные модификации, например гликозилирование, ацилирование, сульфирование или образование дисульфидных связей. Даже когда такие модификации не являются необходимыми, процесс конформационного созревания может быть медленным и отстоять по времени от встраивания в мембрану.
Например, у Е.coli четко наблюдается сборка стабильных тримеров обоих белков, LamB и OmpF, после включения соответствующих мономеров в наружную мембрану, при этом созревание LamB занимает около 5 мин. В эукариотических клетках гликопротеин гемагглютинина вируса гриппа, прежде чем попасть из эндоплазматического ретикулума в комплекс Гольджи, должен сформировать правильную четвертичную структуру, соответствующую зрелой форме. Несвернутые молекулы гемагглютинина остаются в эндоплазматическом ретикулуме. Образование тримеров занимает примерно 7-10 мин. Сходная олигомеризация наблюдается также для G-белка вируса везикулярного стоматита.
Сборка многих субъединичных комплексов, содержащих разные субъединицы, тоже, по-видимому, происходит в эндоплазматическом ретикулуме. Примером служит никотиновый ацетилхолиновый рецептор, который содержит две α-субъединицы и по одной β-, γ- и δ-субъединице (рис.4).
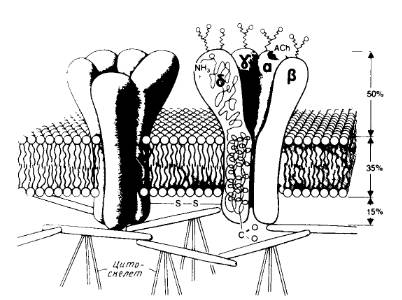
Рис.4. Модель канала никотинового ацетилхолинового рецептора.
Показаны общий вид канала и его расположение в мембране, отмечены участки гликозилирования с наружной стороны и места связывания ацетилхолина на α-субъединицах.
С помощью антител можно различить отдельные формы α-субъединицы: 1) начальный продукт, встраивающийся в эндоплазматический ретикулум; эта форма не может связывать антагонист α-бунгаротоксин; 2) форма, способная связываться с α-бунгаротоксином и образующаяся через несколько минут после завершения трансляции в эндоплазматическом ретикулуме; 3) зрелый рецептор, содержащий все субъединицы (α2βγδ), который обнаруживается через 15мин после завершения трансляции в эндоплазматическом ретикулуме; 4) готовый рецептор на клеточной поверхности, появляющийся спустя примерно 2ч после трансляции. Созревание включает образование дисульфидных связей, олигосахаридный процессинг и ацилирование при участии жирных кислот. Вероятно, определенную роль в сборке, происходящей в комплексе Гольджи, играет фосфорилирование субъединиц.
Решающим фактором процесса сборки является, вероятно, стабильность таких стехиометрических комплексов, как ацетилхолиновый рецептор. По-видимому, в некоторых системах отдельные субъединицы синтезируются в значительном избытке и не образуют стабильных комплексов, а подвергаются протеолитическому расщеплению.
Изучался также процесс созревания и сборки структуры, образующей Na-канал. Необходимым условием созревания является образование дисульфидной связи между α- и β2-субъединицами, однако, это событие происходит спустя примерно 1ч после трансляции и транспорта субъединиц в аппарат Гольджи, а рецептор появляется на клеточной поверхности через 4ч после трансляции. В этом случае свободные α- субъединицы не подвергаются быстрой деградации, а сохраняются в межклеточном пуле и, возможно, используются в дальнейшем в качестве предшественников для формирования канала в растущих нейронах.
Созревшие мембранные белки подвергаются непрерывному обновлению. Период полуобновления Na-канала составляет около 30ч, что типично для поверхностных белков. Обновление большой субъединицы Na/К-АТРазы в растущих клетках в культуре происходит за время 20-40ч. По-видимому, деградация по крайней мере некоторых белков происходит в лизосомах.
Примеры обновления мембранных белков
Стабильность белков в клетке определяется множеством различных факторов. Особенно интересным примером деградации мембранных белков является гидроксиметилглутарил-СоА-редуктаза. Этот фермент находится в гладком эндоплазматическом ретикулуме и регулирует эндогенный синтез холестерола. Деградация его происходит довольно быстро (~2-4ч) и ускоряется при взаимодействии с холестеролом. Для ускорения процесса необходимо наличие мембраносвязанного домена фермента. При определенных условиях в культуре ооцитов китайского хомячка наблюдается сверхпродукция (более 500раз) этого фермента. В результате образуются мембранные трубочки, занимающие 15% клеточного объема и содержащие другие мембранные белки, а также липиды. Добавление холестерола приводит к быстрой деградации избытка мембран, что говорит о координации синтеза и деградации мембранных компонентов.
Другим интересным примером селективного метаболизма мембранных белков является гербицидсвязывающий белок (называемый также белком Dl или QВ) с молекулярной массой 32 кДа из тилакоидов хлоропластов. Этот белок синтезируется как предшественник, созревая внутри отдельных ламелл тилакоида, не собранных в граны, и является частью фотосистемы ΙΙ в ламеллах, входящих в граны. На свету скорость деградации этого полипептида в мембране намного выше, чем других белков. Причина этого явления неизвестна; возможно, оно связано с тем, что в фотосистеме ΙΙ на свету происходят какие-то повреждения.
Выводы
Клетки эукариот содержат много мембранных органелл и множество различных внутриклеточных мембран, каждая из которых обладает уникальным белковым составом. Любой мембранный белок, информация о синтезе которого заключена в ядре, должен безошибочно доставляться от места синтеза на рибосоме, находящейся в цитоплазме, к месту назначения. Для этого используется сложная система сигнальных последовательностей, содержащихся в любой зрелой форме полипептида или предшественника, а также рецепторы внутри клетки, способные эти сигналы распознать. Некоторые мембранные белки включаются в липидный бислой самопроизвольно, но в большинстве случаев правильная сборка белка внутри клеточной мембраны является энергозависимым процессом, который осуществляется с помощью специализированного аппарата. По-видимому, белки не могут включиться в клеточную мембрану до тех пор, пока они не приобретут частично развернутую конформацию. Разворачивание белков или поддержание их в развернутой конформации, необходимой для переноса, возможно, осуществляются при участии АТР и специфических белков в цитоплазме.
Литература
1. Геннис Р. Биомембраны: Молекулярная структура и функции: Пер. с англ. – М.: Мир, 1997.
2. Мари Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека: В 2-х томах. Т.2. Пер. с англ. – М.: Мир, 1993.
3. Мецлер Д. Биохимия. Химические реакции в живой клетке: Пер. с англ. – М.: Мир, 1980.
4. Страйер Л. Биохимия: Пер. с англ. – М.: Мир, 1984. – Т.1.
Похожие работы
... . Все четыре системы являются основными белковыми компонентами мембран, в которых они локализованы, и могут служить иллюстрацией различных уровней организации мультиферментных комплексов в мембранной энзимологии. Первые две системы катализируют анаболические и катаболические реакции, протекающие в присутствии молекулярного кислорода и обычно липофильных мембраносвязанных субстратов. Терминальные ...
... инженерию. Необходимо отметить, что если базовый стандарт по химии не предусматривает изучение вопросов биотехнологии, то таковой по биологии содержит наиболее общие её аспекты: достижения генной инженерии и перспективы биотехнологии. 2.2 Межпредметные связи по изучению аспектов биотехнологии в средней школе По программе Р.Г. Ивановой и Л.А. Цветкова в 10 классе предусмотрено изучение темы ...
... векторов для экспрессии. 2.2 Способы прямого введения гена в клетку Прямое введение гена в клетку осуществляют несколькими способами: 1. Трансфекция 2. Микроинъекция 3. Электропорация 4. Метод «мини-клеток» 5. Упаковка в липосомы 6. Электронная пушка При трансфекции ДНК адсорбируется на кристаллах фосфата кальция (Грэхем Ван дер Эб, ...
0 комментариев