Навигация
Равновесия в неводных растворах
Реферат на тему:
Равновесия в неводных растворах
Выполнила студентка 5го курса
Кекало Екатерина
Минск
Содержание:
Общая схема равновесий в растворах ………………………………………3
1. Ассоциативно-диссоциативные процессы………………………..….3
2. Образование продуктов присоединения …………………….……4
3. Ионизация………………………………………………………………7
4. Электролитическая диссоциация………………………………….….8
Влияние растворителя на равновесие в химических системах…………….9
1. Влияние растворителя на молекулярные ассоциативно-диссоциативные процессы…………………………………………………………………...9
2. Влияние растворителя на константы устойчивости комплексных соединений………………………………………………………………...11
Список литературы ………………………………………………………..…13
ОБЩАЯ СХЕМА РАВНОВЕСИЙ В РАСТВОРАХ
Процессы, сопряженные с образованием раствора, особенно электролитного, неизменно находились в центре внимания общей теории растворов. Именно вокруг вопросов, связанных с числом и характером стадий, предшествующих возникновению электролитного раствора, велись дискуссии между сторонниками различных теорий вопроса. Синтез этих двух основных направлений в учении о растворах в значительной мере был связан именно с установлением общей схемы равновесий в растворах.
1. Ассоциативно-диссоциативные процессы
Ассоциированная молекула растворенного вещества Аx при растворении в растворителе S может претерпевать молекулярную
диссоциацию:
![]()
Последняя может быть связана с физическим влиянием растворителя (например, ослаблением межмолекулярного диполь-дипольного взаимодействия в растворителях с высокой диэлектрической проницаемостью). Однако большей частью энергия, нужная для разрыва связей в ассоциате, черпается из химического взаимодействия между Аx и S:
![]()
Если молекулы растворителя ассоциированы, то образование раствора приводит к изменению этого состояния тем больше, чем больше концентрация раствора. Молекулярная диссоциация растворителя может быть вызвана химическим взаимодействием между А и S:
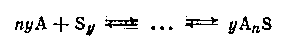
Определение степени ассоциации растворенного вещества в растворе относится к числу наиболее распространенных в практике физикохимического исследования экспериментов. В случае разбавленных растворов для решения этой задачи успешно применяют группу методов, основанных на законе Рауля - эбулиоскопию и, особенно, криоскопию. Большинство сведений о молекулярном состоянии растворенных веществ в разбавленных растворах, которыми располагает в настоящее время физическая химия, получены с помощью последнего метода. К недостаткам криоскопии и эбулиоскопии следует отнести сильное влияние на точность определения флуктуации концентрации в растворе (обстоятельство, которое не всегда учитывается исследователями), а также приложимость этих методов лишь к весьма разбавленным растворам.
Весьма полная информация о молекулярном состоянии растворенного вещества, особенно в тех распространенных случаях, когда образование ассоциатов обусловлено Н-связыо, может быть получено с помощью ИК (КРС)-спектроскопии. Уменьшение степени ассоциации, сопряженное с разрывом Н-связей, приводит к сдвигу частот валентных колебаний ОН в длинноволновую область. Во многих случаях установлена весьма определенная корреляция между сдвигом максимума полосы поглощения и степенью ассоциации. Впрочем, так же, как я в случае методов, основанных на законе Рауля, сколь-нибудь исчерпывающая количественная информация о степени ассоциации по спектроскопическим данным может быть получена в разбавленных растворах.
Ассоциативно-диссоциативные процессы в растворах с несколько более высокой концентрацией могут быть исследованы с помощью ЯМР-спектроскопии: разрыв ассоциатов через Н-связь приводит к сдвигу сигнала протонного магнитного резонанса в Сторону более сильного поля. (В системах, где компоненты содержат арильное ядро, это явление не проявляется с необходимой для точного расчета степени ассоциации четкостью).
С повышением концентрации раствора точность методов определения степени ассоциации быстро падает. Связано это не только с несовершенством экспериментальных и расчетных методик, которые основаны на недостаточном теоретическом обосновании методов, но прежде всего на возрастании по мере роста концентрации раствора степени неопределенности понятия «ассоциация». Действительно, в предельном случае — в индивидуальной жидкости— далеко не всегда бывает очевидным, какой критерий следует положить в основу понятия «степень ассоциации». Определенность, с которой физика вводит это понятие через представления о ближнем и дальнем порядках в жидкости, лимитируется отсутствием четкой границы между «порядками».
Для определения степени ассоциации индивидуальной жидкости предложено несколько методов. Весьма часто для этой цели применяют уравнение Рамзая — Шильдса, использующее данные по поверхностному натяжению у:
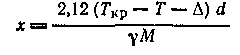
где х—степень ассоциации; Ткр — критическая температура; Т — температура жидкости; Δ — константа, равная приблизительно 279°К; d— плотность; М — формульная молекулярная масса.
Близко по характеру входящих в него величин к данному уравнению примыкает уравнение Беннета — Митчелла
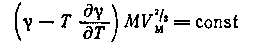
где VM — мольный объем; а М — истинная молекулярная масса.
Похожие работы
... R – СН + Н2О N+Н3 NН2 кислота ВН+ сопряженное основание В (соль белка-основания) (белок-основание) 3.2.Определение pH стандартных буферных растворов Используемые в качестве эталонов для измерений растворы введены давно. Одним из первых таких стандартных растворов использовали «буфер» Вейбеля, представлявший собой раствор ...
... растворения, обусловленного кислотностью среды (i0) имеют порядок по CuC12 в интервале концентраций последнего 10-2 - 10-1 моль/л 2,1. Рис.4. Зависимость скорости коррозии меди в 5М изопропанольных растворах НС1 от содержания Н2О в растворителе. Неподвижный электрод. Комнатная температура. t=2 часа.Рис.5. Поляризационные кривые на меди в ...
... кислота основание Например, НСN + NaOHH2O + NaCN или в ионном виде НСN + OH- H2O + CN- Кислоты и основания, теряющие и приобретающие протоны, называют протолитами. Протолитические растворители, ведущие себя в процессе растворения вещества как кислота, отдавая протон, называют протогенными (от лат. «протонорождающие»). К ним относят жидкие галогеноводороды (HCl, HBr), серную ...
... щелочноземельные металлы (на холоду), железо, углерод и др. (при температуре накаливания). При взаимодействии с сильными окислителями (фтор, хлор, электрический ток и т.д.) вода склонна проявлять восстановительные свойства. Растворы однородны в различных частях объема. Растворение вещества часто происходит с выделением или поглощением тепла, иногда с изменением объема (при смешении 1 л С2Н5ОН и 1 ...
0 комментариев