Навигация
Оксосинтез (гидроформилирование, Ройлен, 1938 г.)
2. Оксосинтез (гидроформилирование, Ройлен, 1938 г.).
При температурах от 30 до 200 °С и давлении 100—400 кгс/см2 (1*1О7 до 4*107 Па) в присутствии дикобальтоктакарбонила олефины присоединяют водород и монооксид углерода с образованием альдегидов. Обычно получается смесь изомеров.
В определенных условиях могут получаться также и кетоны.
3. Гидратация ацетиленов.
Алкины и циклоалкины гидратируются в разбавленных растворах серной кислоты в присутствии сульфата ртути (II). Присоединение протекает по правилу Марковникова и приводит всегда к получению кетонов, за исключением ацетилена, который дает ацетальдегид. На первой стадии тройная связь (возможно, скомплексированная) подвергается нуклеофилыюй атаке водой с промежуточным образованием винилового спирта, который таутомерно превращается в карбонильное соединение. В данном случае кето-енолъное таутомерное равновесие практически полностью сдвинуто в сторону образования альдегида или соответственно кетона.
До последнего времени гидратация ацетилена являлась важнейшим способом производства ацетальдегида.
4. Пиролиз солей карбоновых кислот (Пириа, 1856 г.).
При нагревании кальциевых, бариевых или ториевых солей карбоновых кислот до ~300°С образуются кетоны.
Смеси таких солей с формиатами (солями муравьиной кислоты) дают альдегиды.
В промышленности исходят из самих карбоновых кислот, пары которых при 300 °С пропускают над оксидным марганцевым (II) (для альдегидов) или оксидными кадмиевыми(II) или ториевыми(IV) катализаторами (для кетонов).
5. Восстановление по Розенмунду (1918 г.).
Получение альдегидов прямым восстановлением карбоновых кислот затруднительно, так как обычно процесс не останавливается на стадии образования альдегида и идет дальше. По Розенмунду альдегиды получают гидрированием ацихлоридов над палладием, нанесенным на сульфат бария. В целом ряде случаев катализатор дезактивируют добавками хинолина с серой или тиомочевиной для предотвращения восстановления двойной связи С=О.
6. Восстановление по Стефену (1925 г.)
При восстановлении нитрилов хлоридом олова (II) в соляной кислоте также получаются альдегиды. Промежуточно при этом образуются альдимины, частично выкристаллизовывающиеся в виде гексахлорстаннатов(IV).
В качестве восстановителя все чаще используют также алюмогидрид лития. Это соединение, однако, не следует брать в избытке, поскольку тогда альдимин будет восстанавливаться далее до амина
7. Взаимодействие сложных эфиров с реактивом Гриньяра.
Реакция эфиров муравьиной кислоты с алкил- или арилмагнийгалогенидами дает альдегиды.
Следует избегать избытка реактива Гриньяра; в противном случае образуются вторичные спирты. Поэтому на практике раствор магнийор-ганического соединения прибавляют по каплям к эфиру муравьиной кислоты. Для этих же целей можно использовать и ортоэфиры муравьиной кислоты; в таком случае получаются ацетали, которые далее гидролизуются до альдегидов.
Из эфиров других кислот, в частности и ортоэфиров, получаются кетоны, в последнем случае промежуточно образуются кетали.
Синильная кислота или нитрилы при взаимодействии с реактивом Гриньяра также дают альдегиды или соответственно кетоны.
8. Взаимодействие ацилхлоридов с алкилкадмиевыми соединениями
Диалкилкадмиевые производные используют в синтезе кетонов из ацилгалогенидов, так как в отличие от магнийорганических соединений они не реагируют с карбонильными группами. При синтезах их можно генерировать непосредственно в реакционной смеси.
9. Реакция Сомле (1913 г.).
Хлорметиларены реагируют в водноэтанольном растворе с уротропином с образованием альдегидов.
10. Реакция Этара (1877 г.)
При обработке алкиларенов хромилхлоридом в четыреххлористом углероде образуются альдегиды или кетоны. Например, толуол окисляется до бензальдегида.
Метилареиы можно также окислять действием оксида хрома (VI) в уксусном ангидриде.
11. Ацилирование по Фриделю — Крафтсу (1877 г.)
При взаимодействии аренов с ацилгалогенидами в присутствии кислот Льюиса, таких как хлорид алюминия, получают кетоны.
Ацилирование может быть и внутримолекулярным. В качестве примера приведем синтез инданона-1.
Вместо ацилгалогенидов используются также сами кислоты или их ангидриды. В противоположность алкилированию по Фриделю — Крафтсу, при котором берутся лишь каталитические количества катализатора, при проведении ацилирования по Фриделю — Крафтсу необходимо брать более чем стехиометрические количества катализатора. Это связано с тем, что как ацилирующий агент, так и продукт реакции образуют с катализатором комплекс в соотношении 1:1.
Ацилирование аренов по Фриделю — Крафтсу относится к SЕ-реакциям. В зависимости от условий реагентом является либо комплекс состава 1:1, либо ацил-катион.
В аналогичных условиях ацилируются циклоалканы и олефины. В последнем случае наряду с продуктами ацилировакия получаются также продукты присоединения.
Родственными ацилированию по Фриделю — Крафтсу являются следующие реакции, при которых бензоидный атом водорода замещается на альдегидную группу (формилирование).
Похожие работы
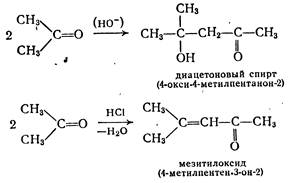
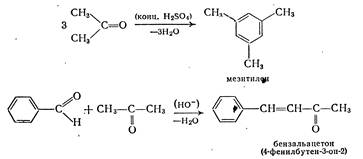
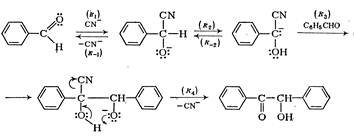
собов, пригодных для синтеза только альдегидов или только кетонов [4]. 1. Окисление или дегидрирование первичных или вторичных спиртов. Важное значение имеет метод окисления по Оппенауэру (1937 г). Он представляет собой процесс, обратный реакции восстановления по Мейервейну - Пондорфу - Верлею, и применяется в основном для получения кетонов из вторичных спиртов. Последние вводят в реакцию с ...
0 комментариев