Навигация
Реакция Гаттермана — Коха (1887 г.)
12. Реакция Гаттермана — Коха (1887 г.)
Арены формилируют смесью моноксида углерода и хлористого водорода в присутствии хлорида алюминия и хлорида меди(I). В противоположность существовавшим ранее представлениям этот синтез альдегидов протекает не через промежуточное образование нестабильного при комнатной температуре формилхлорида, а с участием ацилиевого комплекса, образующегося непосредственно из реагентов.
Роль хлорида меди(I) состоит в первоначальном образовании комплекса с моноксидом углерода, что повышает стационарную концентрацию последнего.
Фенолы и их простые эфиры, а также нитробензол и другие соединения с сильными электроноакцепторными заместителями не вступают в эту реакцию.
13. Реакция Гаттермана (1906 г.)
По этому способу формилирования арены вводят во взаимодействие с синильной кислотой и хлористым водородом. Катализатором служит хлорид алюминия. В реакцию Гаттермана вступают фенол и его простые эфиры, но не вступают нитробензол и ароматические амины.
Вполне возможно, что в данном случае формилирующим агентом является соединение:
![]()
Использования ядовитой синильной кислоты можно избежать, если по Адамсу (1923 г.) в реакцию вводить цианид цинка и хлористый водород.
14. Реакция Вильсмейера — Хаака (1927 г.)
Реакционноспособные и прежде всего многоядерные арены, а также фенолы и их простые эфиры формилируются с образованием альдегидов под действием N,N-дизамещенных формамидов, например N-метилформанилида или N,N-диметилформамида и оксихлорида фосфора.
Промежуточно образующийся комплекс формамида и оксихлорида фосфора в случае N-метилформанилида может быть выделен в свободном виде.
2.2. Химические свойства
1. Реакции с водой и спиртами.
При присоединении к альдегидам воды образуются гидраты (1,1-диолы).
В большинстве случаев это равновесие сильно сдвинуто влево, в сторону исходных реагентов, так что выделить геминальные диоксисоединения невозможно (правило Эрленмейера). Тем не менее такие реакции, как олигомеризация формальдегида и ацетальдегида, протекают с участием гидратов. Соединения, у которых по соседству с карбонильной группой находится электроноакцепторный заместитель, образуют устойчивые гидраты. Примерами таких соединений служат хлораль, трикетоиндан и аллоксан[4].
Присоединение к альдегидам спиртов приводит к полуацеталям, их образование катализируется кислотами и основаниями. В присутствии сильных кислот в результате дальнейшей реакции с новой молекулой спирта образуются ацетали.
Получить кетали из кетонов, присоединяя к ним спирты, нельзя, поскольку равновесие сильно сдвинуто влево. Однако простейшие кетали можно получить при взаимодействии кетонов с ортоэфирами муравьиной кислоты (Хельферих, 1924 г.).
В кислой среде ацетали и кетали гидролизуются до альдегидов и кетонов. Однако по отношению к основаниям они стабильны и используются для защиты карбонильной группы.
2. Реакция с тиоспиртами.
При взаимодействии альдегидов и кетонов с тиоспиртами (меркаптанами) можно получить меркаптали. С этандитиолом-1,2 образуются циклические меркаптали (1,3-дитиоланы).
В присутствии скелетного никеля 1,3-дитиоланы подвергаются гидрогенолизу. Таким путем карбонильные соединения можно восстановить до углеводородов.
3. Образование бисульфитных соединений.
При обработке концентрированным водным раствором бисульфита натрия альдегиды и кетоны образуют соли оксисульфокислот, так называемые бисульфитные соединения.
Бисульфитные соединения плохо растворимы и используются для отделения альдегидов и кетонов. Нагревание этих соединений с разбавленными кислотами или с водным раствором карбоната натрия приводит к регенерации карбонильных соединений.
4. Реакции с аминосоединениями.
Соединения структуры Z—NH2 легко присоединяются к альдегидам и кетонам. Однако в большинстве случаев продукты присоединения неустойчивы и легко дегидратируются через промежуточные карбений-иммониевые ионы.
При взаимодействии альдегидов с аммиаком, протекающем через стадию малостабильных альдегидаммиаков, образуются альдимины.
Альдимины обычно тримеризуются в гексагидро-1,3,5-триазины.
Реакция с формальдегидом протекает сложнее. Бензальдегид также реагирует иначе, взаимодействие его с аммиаком приводит к гидробензамиду.
В случае таких кетонов, как ацетон, аммиак вызывает альдольную реакцию. Образующиеся при этом димеры или тримеры далее реагируют с аммиаком с образованием диацетонамина (4-амино-4-метилпентанона-2) или триацетонамина (2,2,6,6-тетраметил-пиперидон-4).
Первичные амины конденсируются с альдегидами в азометины (основания Шиффа).
В большинстве случаев азометины представляют собой кристаллические соединения и используются для выделения, очистки и идентификации альдегидов.
Большее значение для этой цели имеют гидразоны, фенилгидразоны, 4-нитрофенилгидразоны и 2,4-динитрофенилгидразоны, образующиеся при взаимодействии альдегидов и кетонов с гидразином или соответствующим замещенным гидразином. При реакции с гидразином могут получаться также кристаллические азины.
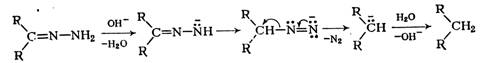
При нагревании с гидроксидом калия в триэтиленгликоле до ~200°С или при действии трет-бутилата калия в диметилсульфоксиде гидразоны теряют азот и образуют углеводороды (реакция Вольфа—Кижнера, 1912 г.). Реакция, вероятно, протекает по следующему механизму:
Гидроксиламин, а также семикарбазид конденсируются с альдегидами и кетонами.с образованием соответственно оксимов и семикарбазонов, также используемых для идентификации карбонильных соединений.
Азометины, гидразоны, азины, оксимы и семикарбазоны более или менее легко могут быть гидролизованы обратно до исходных карбонильных соединений. Регенерация кетонов из 2,4-динитрофенилгидразонов легче всего осуществлять нагреванием с гидратом толуол-4-сульфокислоты в хлороформе. Оксимы, кроме того, являются промежуточными продуктами в ряде синтезов. Например, (Z)-альдоксимы дегидратируются до нитрилов. В противоположность этому (E)-диастереомеры вследствие стереоэлектронных эффектов не вступают в реакцию; в условиях дегидратации эти соединения претерпевают перегруппировку Бекмана до N-замещенных формамидов.
В присутствии серной кислоты, хлорида фосфора(V), полифосфорной кислоты или других катализаторов кетоксимы также претерпевают перегруппировку Бекмана (1886 г.) с образованием N-замещенных амидов карбоновых кислот. На примере оксимов несимметричных кетонов установлено, что при этом имеет место анти-перегрупаировка: гидро-ксильная группа меняется местами с остатком, находящимся к ней в транс-положении.
При действии на альдегиды и кетоны вторичных аминов первоначально также протекает присоединение. Если в α-положении к карбонильной группе имеется протон, то нестабильное промежуточное соединение стабилизуется, отщепляя воду и образуя енамин.
Енамины являются очень реакционноспособными соединениями и используются во многих синтезах. Если, как в случае бензальдегида, в α-положении к карбонильной группе не имеется атома водорода и, таким образом, отщепление воды невозможно, то промежуточно образующийся карбений-иммониевый ион присоединяет вторую молекулу амина с образованием аминаля.
Похожие работы
собов, пригодных для синтеза только альдегидов или только кетонов [4]. 1. Окисление или дегидрирование первичных или вторичных спиртов. Важное значение имеет метод окисления по Оппенауэру (1937 г). Он представляет собой процесс, обратный реакции восстановления по Мейервейну - Пондорфу - Верлею, и применяется в основном для получения кетонов из вторичных спиртов. Последние вводят в реакцию с ...
0 комментариев