Навигация
5. Циангидринный синтез
Присоединение синильной кислоты в присутствии основных катализаторов к альдегидам и некоторым кетонам приводит к циангидринам (α-оксинитрилам).
Под действием щелочей циангидрины расщепляются, при кислом гидролизе образуют α-оксикарбоновые кислоты.
6. Альдольная реакция
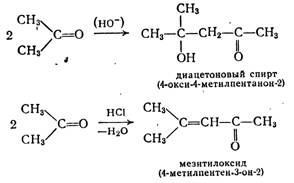
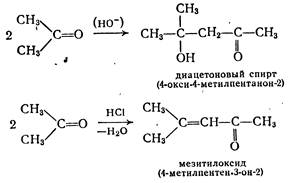
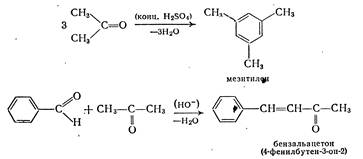
Взаимодействие альдегидов или кетонов (карбонильная компонента) самих с собой или с другими альдегидами и кетонами, выступающими в качестве С—Н-кислотной компоненты (метиленовой компоненты) с образованием (β-оксикарбонильных соединений, называют альдольной реакцией. Кислоты и основания катализируют эту реакцию. Например, в присутствии гидроксидов щелочных или щелочноземельных, металлов из ацетальдегида образуется ацетальдоль («аль» от альдегида и «ол» от спирта) 3-оксибутаналь.
Какая из стадий реакции (первая или вторая) будет определять скорость всего превращения, зависит от кинетической кислотности метиленовой компоненты и от электрофильности карбонильной компоненты. В случае альдолыюй реакции с ацетальдегидом наиболее медленной является первая стадия, в случае ацетона из-за меньшей реакционной способности его карбонильной группы — вторая стадия.
При повышенных температурах часто протекает дегидратация, приводящая к α,β-непредельным соединениям. Так, из ацетальдоля получают кротоновый альдегид.
При кислотном катализе альдольная реакция протекает через енольную форму, причем отщепление воды наблюдается почти всегда.
Примером альдолыюй реакции между различными альдегидами является образование пентаэритрита из ацетальдегида и формальдегида в присутствии гидроксида кальция. При этом в заключение протекает перекрестная реакция Канниццаро между образовавшимся альдегидом и молекулой формальдегида.
Аналогично альдегидам реагируют и кетоны, например:
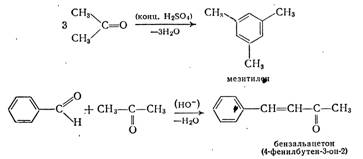
Как и в случае реакции бензальдегида с ацетоном, кетоны при реакции с альдегидами всегда играют роль метиленовой компоненты. В последнее время предпочитают использовать азометины альдегидов, поскольку для альдегидов, содержащих в α-положении атом водорода, предпочтительной является самоконденсация.
По схеме альдольной реакции протекают реакции и других С-Н-кислотных соединений с карбонильными соединениями. К ним относятся конденсация Кневенагеля, реакция Перкина и синтезы оксиранов (глицидный синтез) по Дарзану.
7. Бензоиновая конденсация
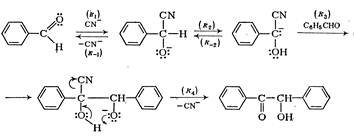
При действии водно-спиртовых растворов цианида калия арилальдегиды димеризуются в α-оксикетоны. Из бензальдегида образуется бензоин.
Считается доказанным следующий механизм этой реакции:
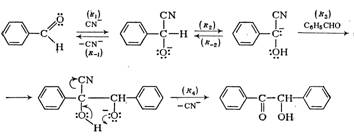
Как и в альдольной реакции, карбанион присоединяется к альдегиду.
Алифатические альдегиды дают в этих условиях не ацилоины, а альдоли, образования ацилоинов из этих соединений можно добиться, используя ферменты определенных видов дрожжей.
8. Реакция Канниццаро (1853 г.)
Альдегиды, не содержащие в α-положении к карбонильной группе атома водорода, т. е. преимущественно ароматические альдегиды, в присутствии гидроксидов щелочных или щелочноземельных металлов диспропорционируют до спирта и кислоты.
В случае альдегидов, имеющих α-атом водорода, гораздо быстрее протекает альдольная реакция. Формально атом водорода одной молекулы альдегида в виде гидрид-иона переносится к связи С=О другой молекулы. Начинается этот процесс с присоединения гидроксил-иона. Затем с участием атома металла образуется комплекс, внутри которого и происходит гидридный перенос.
Если в реакции принимают участие два различных альдегида, то говорят о перекрестной реакции Канниццаро. В таком случае формальдегид всегда играет роль донора гидрид-иона.
9. Реакция Кляйзена — Тищенкр (1906 г.)
При взаимодействии любых альдегидов с алкоголятом алюминия происходит гидридный перенос, поскольку основность этого реагента недостаточна для осуществления альдольной реакции. В результате образуются сложные эфиры карбоновых кислот.
Реакция также протекает через образование комплекса.
10. Восстановление по Мейервейну—Пондорфу—Верлею (1925, 1926 гг.)
В обращение окисления по Оппенауэру, при нагревании альдегидов и кетонов с каталитическими количествами изопропилата алюминия в растворе изопропанола происходит их восстановление, соответственно до первичных и вторичных спиртов. В образующемся комплексе происходит гидридный перенос от алкоксид-иона на карбонильное соединение. При этом устанавливается равновесие, сдвиг которого вправо осуществляют за счет непрерывной отгонки ацетона из реакционной смеси.
11. Аминометилирование (реакция Манниха, 1917 г.)
Кетоны, содержащие в α-положении атом водорода, как С-Н-кислоты аминометилируются при взаимодействии с формальдегидом (или другими альдегидами) и аммиаком или при взаимодействии с первичными или вторичными аминами. Реакция в большинстве случаев проводится в присутствии кислот, хотя возможен и основной катализ. Первоначально образуется карбений-иммониевый ион, реагирующий далее с енольной формой кетона.
Конечные продукты реакции Манниха называют основаниями Манниха.
12. Пинаконовое восстановление
При восстановлении кетонов натрием или амальгамами натрия или магния образуются 1,2-диолы (пинаконы, важнейшие спирты и фенолы, пинакон). К тем же результатам приводит и электрохимическое восстановление (катодное восстановление). Такого типа реакции идут на поверхности металлов и протекают через анион-радикалы, так называемые кетилы.
Бензальдегид при реакции с амальгамой натрия или цинка также может быть превращен в 1,2-диол.
13. Восстановление по Клёменсену (1913 г.)
При реакции с амальгамированным цинком и концентрированной соляной кислотой альдегиды и кетоны превращаются в углеводороды.
14. Окисление альдегидов
Альдегиды очень легко окисляются до карбоновых кислот, являясь таким образом восстановителями.
Так, они восстанавливают аммиачный раствор нитрата серебра (реактив Толленса) до серебра, а щелочной раствор гидроксида висмута (III) с добавкой комплексообразователя — винной кислоты (реактив Ньюленда) — до металлического висмута.
Алифатические альдегиды выделяют оксид меди(I) из щелочного раствора гидроксида меди(II), содержащего в качестве комплексообразователя тартрат калия-натрия (реактив Фелинга).
На воздухе бензальдегид подвергается автоокислению до бензойной кислоты. В данном случае протекает радикальный процесс, идущий через промежуточное образование среди других бензоильных радикалов и пербензойной кислоты.
15. Реакция Вильгеродта — Киндлера (1887, 1923 гг.)
При нагревании алкиларилкетонов в запаянных ампулах с водными растворами полисульфида аммония или, проще, с серой и первичными или вторичными аминами (чаще всего с морфолином) образуются амиды ω-арилкарбоновых кислот или сами кислоты. Механизм этой реакции очень сложен, промежуточно образуются енамины (Майер, 1964 г.).
Выводы
Таким образом, в данной работе рассмотрен бензальацетон, его свойства, способы получения и применение. Взаимодействием бензальдегида с ацетоном получен бензальацетон с выходом …г или …% масс. от теоретического. Определена температура плавления, показана сходимость полученных данных с литературными, а следовательно, очень низкая доля примесей в полученном бензальацетоне и чистота продукта синтеза.
Список литературы
1. Нейланд О.Я. Органическая химия, М.: Высшая школа, 1990, 751с.
2. Голодников Г.В. Практические работы по органическому синтезу. Л., Изд-во ЛГУ, 1966, 697с.
3. Физер Л., Физер М. Реагенты для органического синтеза. Том 2. М., Мир, 1970, 390.
4. З. Гауптман, Ю. Грефе, Х. Ремане Органическая химия, Москва, «Химия», 1979, 832
5. Кнунянц И.Л. Большая Российская энциклопедия, М.: 2003, 972с.
6. Юрьев Ю.К. Практические работы по органической химии. Выпуск 1 и 2. Изд. 3-е. М., Изд-во МГУ, 1964.
7. Юрьев Ю.К., Левина Р.Я., Шабаров Ю.С., Практические работы по органической химии. Выпуск 4. М. Из-во МГУ, 1969.
8. Шабаров Ю.С. Органическая химия: В 2-х кн. - М.:Химия, 1994.- 848 с.
9. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. – М.: Высш. шк., 1973. - 623 с.
10. Моррисон Р., Бойд. Органическая химия. - М.: Мир, 1974. - 1132 с.
11. Терней А. Современная органическая химия: В 2 т. - М.: Мир, 1981. - Т.1 - 670 с; Т.2 - 615 с.
12. Робертс Дж., Кассерио М. Основы органической химии: В 2 т. - 2-е изд. -М.: Мир, 1978. - Т.1 - 842 с; Т.2 - 888 с.
13. В. Ф. Травень. Органическая химия. Том 1. – М.: Академкнига, 2004, - 708 с.
14. Птицина О.А., Куплетская Н.В., Тимофеева В.К. и др. Лабораторные работы по органическому синтезу. М.: Просвещение, 1979, 256с
15. Исагулянц В.И. Синтетические душистые вещества, 2 издание, Ереван, 1946, 831с.
Похожие работы
собов, пригодных для синтеза только альдегидов или только кетонов [4]. 1. Окисление или дегидрирование первичных или вторичных спиртов. Важное значение имеет метод окисления по Оппенауэру (1937 г). Он представляет собой процесс, обратный реакции восстановления по Мейервейну - Пондорфу - Верлею, и применяется в основном для получения кетонов из вторичных спиртов. Последние вводят в реакцию с ...
0 комментариев