Навигация
Синтез и анализ ХТС в производстве ацетона
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ТЕХНОЛОГИЧЕСКИЙ ИНСТИТУТ
ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
КАФЕДРА ХИМИЧЕСКОЙ ТЕХНОЛОГИИ
КУРСОВАЯ РАБОТАпо дисциплине «Общая химическая технология»
на тему:
СИНТЕЗ И АНАЛИЗ ХТС В ПРОИЗВОДСТВЕ АЦЕТОНА
Выполнил:
студент группы
Проверил:
2008 г.
1. Содержание
1. Содержание 2
2. Задание
3. Введение
4. Синтез ХТС
Обоснование создания эффективной ХТС
Определение технологической топологии ХТС
Установление технологических и конструкционных
параметров ХТС, технологических параметров
режима и потоков
Химическая модель ХТС
Функциональная модель ХТС
Структурная модель ХТС
Операторная модель ХТС
Технологическая схема ХТС
5. Анализ ХТС
Представление изучаемого объекта в виде
иерархической структуры ХТС
Построение математической модели ХТС
Изучение свойств и эффективности
функционирования ХТС
6. Заключение
2. Задание
Какое количество гидроперекиси изопропилбензола необходимо, если известно, что в процессе разложения получается 6 т. толуола, степень разложения 80 %
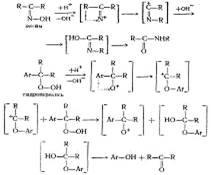
3. Введение
Ацетон СН3СОСН3 известен с 1732 г как продукт сухой перегонки солей уксусной кислоты и ранее назывался пироуксусным эфиром. Состав ацетона определили Ю. Либих и Ж. Дюма в 1832 г., а А. Уильямсон установил его строение (1852 г), которое позднее было подтверждено синтезом ацетона из цинк-диметила и хлористого ацетила.
Долгое время ацетон не имел широкого применения и производился в небольших масштабах термическим разложением уксуснокислого кальция («уксусного порошка»), получаемого при сухой перегонке древесины."
Вследствие зарождения и развития химии синтетических материалов возникла потребность в таком хорошем растворителе, каким является ацетон; это заставило искать новые способы его получения.
В настоящее время ацетон широко применяется в качестве растворителя в различных отраслях промышленности. Он является также сырьем для синтеза целого ряда соединений, в том числе растворителей более сложного строения, таких, как диа-цетоиовый спирт, окись мезитила, метилизобутилкетон, метил-изобутилкарбинол; из ацетона (через ацетонциангидрин) получают метилметакрилат, применяемый в производстве органического стекла, изофорон, уксусный ангидрид, дяфенилолпропан и другие продукты.
Разнообразие областей применения ацетона вызвало быстрый рост его производства.
В Российской Федерации ацетон применяется главным образом как растворитель в производстве автомобильных, авиационных, кабельных, кожевенных и других лаков и эмалей, кинопленок, фотореагентов, целлулоида, ацетатного шелка и т. п. Для химических синтезов используется лишь небольшая часть ацетона.
В данной работе приводится анализ различных способов получения ацетона, выбор оптимальной технологической схемы, обеспечивающей экономически эффективный, технологически целесообразный и экологически безопасный метод производства.
4. Синтез ХТС
Производство ацетона брожением крахмала
Ферментативный метод является самым старым методом получения ацетона в промышленных масштабах. В результате жизнедеятельности некоторых видов бактерий (Bacyllus acetobutylicus и др.) крахмал превращается в ацетон и n-бутиловый спирт. В качестве сырья для этого процесса чаще всего применяют кукурузную муку; из 100 кг муки можно получить 12 кг n-бутанола, 6 кг ацетона и 2 кг этилового спирта [1].
Производство ацетона из изопропилового спирта
Изопропиловый спирт в довольно больших количествах вырабатывается в различных странах путем сернокислотной или прямой гидратации пропилена. Основным потребителем изопропилового спирта является производство ацетона, который может быть получен из него двумя методами: каталитическим дегидрированием и неполным окислением (в паровой или жидкой фазе).
Каталитическое дегидрирование изопропилового спирта. Метод каталитического дегидрирования изопропилового спирта в ацетон осуществляется в промышленности США с 1923 г. и получил широкое распространение в других странах. Принципиальная схема производства ацетона этим методом показана на рис. 1. Процесс протекает в одну стадию то реакции:
СН3СН(ОН)СН3 → СН3СОСН3 + Н2 – 69,9 кДж (16,7 ккал)
В качестве катализатора Используется главным образом окись цинка, осажденная на пемзе. Повышение температуры способствует сдвигу равновесия реакции в сторону образования ацетона. По данным Кольбе и Барвелла [1], степень превращения Изопропилового спирта в ацетон при 225 °С составляет 84%, три 325 °С – 97%, при 525 °С – 100%, однако в последнем случае в значительной степени протекают побочные реакции.
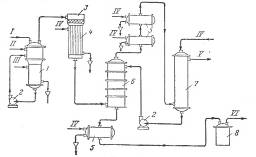
Рис. 1. Принципиальная схема производства ацетона дегидрированием изопропилового спирта:
1 – испаритель; 2 – насосы; 3 – реактор; 4 – водяной холодильник смешения; 5 – холодильники; 6 – башня снасадкой; 7 – Водяной скрубберу; 9 – сборник ацетона
I – изопропиловый спирт; II – водород; III – пар; IV – вода; V – отходящие газы; VI – товарный ацетон.
Для предотвращения образования продуктов полимеризации, отравляющих катализатор, исходный изопропиловый спирт смешивают в паровой фазе с эквимолекулярным количеством водорода. Реакцию проводят яри 380°С, степень превращения изопропилового спирта составляет 98%. Реактор представляет собой заполненный катализатором трубчатый аппарат, межтрубное пространство которого обогревается топочными газами.
После 10 суток работы требуется регенерация катализатора, так как активность его уменьшается вследствие отложения углерода на поверхности. Регенерацию осуществляют пропусканием через слой катализатора азота, содержащего – 2% кислорода, при 500 °С, Срок службы катализатора – около 6 месяцев.
Контактные газы из реактора поступают на охлаждение (при котором конденсируется около 50% ацетона), после чего их промывают водой, поглощающей ацетон. Промывные воды подвергаются фракционированию и азеотропной перегонке для выделения товарного ацетона и безводного изопропилового спирта, снова направляемого на дегидрирование.
Водород после промывки от ацетона возвращается на разбавление спирта, а водород, образовавшийся при дегидрировании, выводится из системы и используется для других синтезов. Выход ацетона составляет около 90% (считая на изопропиловый спирт). На 1 т ацетона расходуется 1,1—1,2 т изопропилового спирта или около 0,9 т пропилена [1].
Французским институтом нефти разработан способ дегидрирования изопропилового спирта в жидкой фазе. Катализатором процесса служит суспендированный в исходном спирте никель Ренея, реакцию проводят при 150 °С. В этих условиях достигаются почти количественные выходы ацетона.
Неполное окисление изопропилового спирта в паровой фазе.
Реакция неполного окисления изопропилового спирта
СН3СН(ОН)СН3 + 0,5 О2 → СН3СОСН3 + Н3О + 180 кДж (43 ккал)
протекает в присутствии металлических катализаторов – меди, серебра, никеля, платины и т. д.
Высокий выход ацетона достигается при использовании серебра, осажденного на пемзе, или серебряной сетки. Температура реакции может изменяться в широких пределах (450— 650 °С) и выбирается в зависимости от применяемого катализатора, объемной скорости паров спирта и воздуха и других факторов.
Перед подачей реагентов в контактный аппарат (рис. 2) изопропиловый спирт испаряют в испарителе-сатураторе, насыщают парами воздуха и перегревают полученную паровоздушную смесь. Реакция протекает в адиабатических условиях, т. е. тепло, выделяющееся в процессе окисления, воспринимается самой реакционной смесью.
При окислении, «роме ацетона, образуется также некоторое количество побочных продуктов, в том числе уксусной кислоты и ацетальдегида. Поэтому контактные газы после прохождения ими металлического катализатора пропускают через насадку в виде слоя мела, на которой уксусная кислота и ацетальдегид почти количественно превращаются в ацетон. Оптимальной для этой реакции является температура 450 °С, достигаемая охлаждением контактных газов во встроенном в реактор змеевике.
Из контактного аппарата газы поступают в котел-утилизатор, а затем последовательно на «парциальную» конденсацию и водную абсорбцию. Несконденсировавшиеся газы после абсорбции ацетона водой сбрасывают в атмосферу. Промывные воды из скруббера объединяют с конденсатом и направляют на ректификацию.
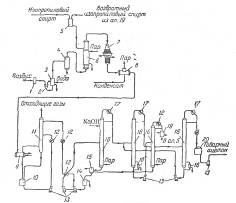
Рис. 2. Принципиальная схема производства ацетона неполным окислением изопропилового спирта в паровой фазе:
1 – висциновый фильтр; 2 – ротационный компрессор; 3, 9, 12, 19 – холодильники; 4 – ресивер; 5 – сборник изопропилового спирта; 6 – испаритель-сатуратор; 7 – контактный аппарат; 8 – котел-утилизатор; 9 – сборник конденсата; 10 – скруббер; 11 – насосы; 12 – сборник сточной воды; 15 – сепаратор; 16 – ректификационные колонны; 17 – дефлегматоры; 18 – кипятильники; 20 – сборник ацетона.
В первой по ходу процесса ректификационной колонне из водного раствора отгоняют ацетон и изопропиловый спирт. В верхнюю часть колонны для очистки от осмоляющихся примесей подают 15%-ный раствор NaOH. Вода из куба колонны после осаждения органических веществ и утилизации ее тепла подается в скруббер на абсорбцию ацетона.
В следующей колонне происходит разделение продуктов на ацетон-сырец и раствор изопропилового спирта. Ацетон-сырец поступает на ректификацию для выделения товарного ацетона; изопропиловый спирт выделяют перегонкой из водного раствора и возвращают на окисление.
Неполное окисление изопропилового спирта в жидкой фазе.
Интересным методом получения ацетона из изопропилового спирта является его неполное окисление и жидкой фазе. Этот метод, применяемый для производства перекиси водорода, осуществляется с 1957 г. на заводе фирмы «Shell Chemical Со.» в США [2].
Процесс протекает по схеме
СН3СН(ОН)СН3 + О2 → СН3СОСН3 + Н2О2
и проводится автокаталитически при 90 – 140°С под давлением, позволяющем удерживать смесь в жидкой фазе. В качестве окислителя можно применять как воздух, так и кислород.
Реактор должен быть изготовлен из материалов, не разлагающих перекись водорода. На окисление подают 89%-ный раствор изопропилового спирта; по достижении концентрации перекиси водорода 15 – 25% продукт выводится из реактора, разбавляется водой и стабилизируется. Ацетон и не прореагировавший спирт отгоняют и очищают, перекись водорода концентрируют быстрым испарением и вакуум-перегонкой.
Выход ацетона составляет 95% от теоретического, выход перекиси водорода – около 87 %25.
Другие методы получения ацетона
Ацетон получается также в качестве побочного продукта в синтезе аллилового спирта из изопропилового спирта и акролеина:
СН3–СН(ОН) –СН3 + СН2=СН–СНО → СH2=СН–СН2ОН + СН3–СО–СН3
Эта реакция проводится в паровой фазе при 350–450 °С и атмосферном давлении в присутствии катализатора – смеси окиси магния и окиси цинка.
Данный процесс, так же как и процесс получения ацетона и перекиси водорода из изопропилового спирта, является составной частью синтеза глицерина по методу американской фирмы «Shell Chemical Со.»:
|
| ||||
а) пропилен → изопропиловый спирт → ацетон + перекись водорода
|
б) пропилен → акролеин
в) акролеин + изопропиловый спирт → аллиловый спирт + ацетон
г) аллиловый спирт + перекись водорода → глицерин.
Значительные количества ацетона производят из этилового спирта, ацетилена и уксусной кислоты. Все три процесса по механизму, вероятно, сходны между собой.
Реакция
2С2Н5ОН + Н2О--- → СН3СОСН3 + СО2 + 4Н2
протекает при взаимодействии паров этилового спирта и воды в присутствии катализатора — окиси железа, активированной известью; температура процесса 470 °С. Водной промывкой из контактных газов выделяют ацетон в виде 5%-ного водного раствора. Выход ацетона по этиловому спирту составляет 86% [2]. Катализатор нуждается в периодической регенерации, общий срок его службы — 6 месяцев. Реакцию
2СН=СН + ЗН2О → СН3СОСН3 + СО2 + 2Н2
проводят пропусканием ацетилена в смеси с избытком водяного пара над катализатором, состоящим из окисей цинка и железа. Процесс протекает при той же температуре (470 °С), что и синтез ацетона из этилового спирта. Катализатор периодически регенерируют. При промывке контактных газов водой получают 10%-ный водный раствор ацетона, который подвергают ректификации. Выход ацетона равен 85% от теоретического. Эта реакция успешно осуществлялась даже при применении газа, содержащего 8% ацетилена («разбавленный» ацетилен).
В обоих описанных процессах ацетон получается, по-видимому, в результате декарбоксилирования промежуточно образующейся уксусной кислоты, способность которой превращаться в (СН3)2СО при нагревании с солями металлов (например, с ацетатом кальция) известна уже давно.
Это обстоятельство использовано для оформления в промышленном масштабе процесса производства ацетона пропусканием паров уксусной кислоты над окисью церия (осажденной на пемзе) при 400—450 0С и атмосферном давлении:
2СН3СООН → СН3СОСН3 + СО2 + Н2О
Выход ацетона достигает 95% от теоретического.
Одним из путей получения ацетона в промышленности является каталитическое окисление пропан-бутановых смесей при низкой температуре и высоком давлении, осуществленное в США фирмами «Gelanese Corporation of America» и «Warren Petroleum Co.».
Наряду с ацетоном в этом процессе образуются также уксусная кислота (главный продукт), метилэтилкетон, ацетальдегид, метанол, муравьиная, пропионовая и масляная кислоты и различные лактоны.
Недавно была показана возможность синтеза ацетона прямым окислением пропилена в присутствии хлористого палладия. Сообщают, что пропилен легко превращается в ацетон в течение 5 мин при 20 °С; выход ацетона составляет 90% от теоретического.
Процесс окисления пропилена, выражаемый суммарным уравнением
СН3СН=СН2 + 0.5 О2 → СН3СОСН3
протекает в две стадии:
а) СН3СН=СН2 + РbС12 + Н2О → СН3СОСН3 + Рb + 2НС1
б) Рb + 2НС1 + 0.5 О2 → Рb С12 + Н2О
На практике процесс осуществляется значительно сложнее. Реакционной средой является водный раствор солей палладия, железа и меди. В этот раствор пропускают олефин. Хлористый палладий дает с олефином комплекс, который легко разрушается с образованием карбонильного соединения, металлического палладия и соляной кислоты. Металлический палладий немедленно окисляется в хлорид солями железа и меди, которые при этом переходят в соли низшей валентности. Окисление солей меди и железа в соли с высшей валентностью осуществляется кислородом (или кислород-азотной смесью). Таким образом, указанные соли являются переносчиками кислорода.
Процесс может быть оформлен в одну стадию, если в реактор, содержащий раствор солей, одновременно поступают олефин и кислород, или в две стадии, когда олефин и кислород подаются в два отдельных реактора, между которыми циркулирует раствор солей.
Такой способ окисления олефинов в настоящее время разработан применительно к процессу получения ацетальдегида из этилена.
Наконец, как уже указывалось, ацетон получается в качестве побочного продукта в синтезе фенола по кумольному методу. Этот метод значительно сложнее технологически, но при реализации достаточно больших объёмов производства позволяет намного снизить себестоимость продукта.
Похожие работы
... , необходимо отметить, что во многих случаях следует комплексно использовать их, дополняя совершенствованием организации и управления производством, расширением и углублением научных исследований в области химической технологии, а также улучшением проектной деятельности соответствующих организаций. Новым мощным средством повышения эффективности ряда производств следует считать внедрение атомной ...
... сопряжения с системами иных функциональных назначений, смежных с используемой (если таковые имеются) [3]. ОБЗОР ИСПОЛЬЗУЕМЫХ И ПРОЕКТИРУЕМЫХ СИСТЕМ Наибольшее распространение системы химического мониторинга получили в химической технологии при моделировании технологических процессов. Так, производства нитроглицерина, тротила, аммиачной селитры, фосфатов и других крупнотоннажных продуктов ...
... приводят к гибели наркоманов? Какие факторы способствуют высокой смертности? Причины: травмы - в дорожных происшествиях, по неосторожности, в "разборках"; передозировки; отравления некачественными наркотиками; заболевания - сепсис, пневмония, хроническая печеночная недостаточность. Факторы, способствующие высокой смертности: высокая вовлеченность в криминальные отношения, невнимательность и ...
... наркотической зависимости. Возвращение к людям, к обществу - это совместный труд врачей, семьи, педагогов. Полный курс лечения от наркомании и токсикомании состоит из четырех этапов. Первый этап - нейтрализация ядов в организме человека. С помощью специальных растворов и медикаментов осуществляется выведение и избавление организма от наркотических веществ. Процесс выведения наркотиков особенно ...



0 комментариев