Навигация
Иерархическая структура ХТС
5.1 Иерархическая структура ХТС
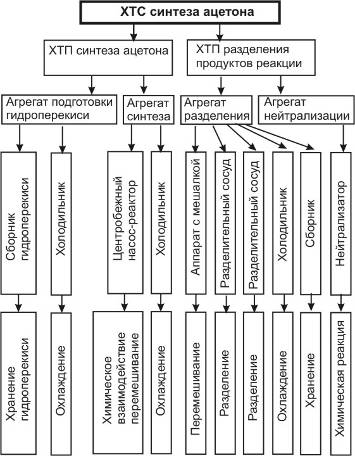
5.3 Изучение свойств и эффективности функционирования ХТС
Изопропилбензол (кумол) С6Н5СН(СН3)2, молекулярная масса 120,20; бесцветная жидкость с запахом бензола; Тпл. - 96 °С, т. кип. 152,4°С, 38,2°С/10 мм рт. ст.; d420 0,8618; nD20 1,4915; давление пара (в кПа): 1 (33,22 °С), 20 (99,08 °С), 80 (143,5 °С); h 0,791 мПа×с (20°С), 0,612 мПа×с (40°С); γ 28,2 мН/м (20°С); tкрит 351,4°С, ркрит 3220 кПа; С0р 197 Дж/(моль.К); DH0исп 367 кДж/кг (25 °С), ΔH0обр -41,3 кДж/моль (25 °С); смешивается с этанолом, диэтиловым эфиром, ацетоном, бензолом, хлороформом; р-римость в воде менее 0,01% (20 oC). Изопропилбензол - типичное ароматическое соединение (легко алкилируется, хлорируется, сульфируется, нитруется в ядро). В промышленности изопропилбензол получают каталитическим алкилированием бензола пропиленом; реакция осложняется последовательным введением алкильных радикалов в образовавшийся И. вплоть до получения гексаизопропилбензола. В способе производства изопропилбензол, осуществленном в РФ, катализатором алкилирования служит хлоралюминиевый каталитический комплекс (АlСl3 с НСl и алкилароматическим углеводородом). Процесс осуществляют при 100-130°С (давление определяется т-рой), мольное соотношение бензол : пропилен (с учетом возвращаемых в реакцию полиалкилбензолов) составляет 3:3,5. Полученный изопропилбензол отмывают от катализатора последовательно 17-25%-ным раствором АlСl3, 3-5%-ным раствором NaOH и водой, подвергают ректификации. Расход бензола и пропилена на производство 1 т И. составляет 0,692 и 0,372 т соотв., АlСl3 - 5,5кг. Недостаток метода - необходимость использования коррозионностойкого оборудования. Все большее промышленное использование находит гомофазное алкилирование в присутвии растворимых количеств хлоралюминиевого каталитического комплекса. В этом методе упрощается технологическая схема процесса, возрастает скорость реакции, уменьшается коррозионная активность реакции среды и снижается выход побочных продуктов. За рубежом для производства И. используют фосфорнокислотные катализаторы на твердом носителе - глине, кизельгуре, силикагеле или алюмосиликате. Процесс осуществляют при температуре около 200 °С и давлении 2,8-4,2 МПа. Чтобы предотвратить дезактивацию катализатора, в реакционную зону вводят воду (0,06-0,08% по массе от массы сырья). С целью сокращения образования полиалкилбензолов процесс ведут при мольном соотношении бензол: пропилен, равном 10:1. Выход изопропилбензола 96-97% в расчете на бензол и 91-92% в расчете на пропилен. Применяют изопропилбензол для производства главным образом фенола и ацетона (через кумилгидропероксид) и α-метилстирола, а также как добавку к авиационным бензинам, повышающую октановое число, Твсп. 38 °С, КПВ 0,88-6,5%. При ингаляции вызывает острые и хронические поражения кроветворных органов (костного мозга, селезенки).
Ацетон (от латинского acetum - уксус) (2-пропанон, диметилкетон) СН3СОСН3, мол. м. 58,079; летучая бесцветная жидкость с характерным запахом; Тпл. - 94,6°С, Ткип. 56,1 °С; d420 0,7920, nD20 1,3588; η 0,36 мПа×с (10°С), 0,30 мПа×с (30 С); γ 0,0237 Н/м (20°С); tкрит 235,5°С, pкрит 4,75 МПа; С°р 749,3 Дж/(кмоль×К); ΔH°исп 29,1 кДж/моль (56,1 °С), ΔН°сгор -1787кДж/моль, ΔН°обр - 216,5 кДж/моль (газ; 25°С) и - 248 кДж/моль (жидкость). Смешивается с водой и органическими растворителями, например эфиром, метанолом, этанолом, сложными эфирами. Ацетон обладает всеми химическими свойствами, характерными для алифатических кетонов. Образует кристаллические соединения с гидросульфитами щелочных металлов, напр. с NaHSO3 - (CH3)2C(OH)SO3Na. Только сильные окислители, например щелочной раствор КМnО4 и хромовая кислота, окисляют ацетон до уксусной и муравьиной кислот и далее - до СО2 и воды. Каталитически восстанавливается до изопропанола, амальгамами Mg или Zn, а также Zn с СН3СООН - до пинакона (СН3)2С(ОН)С(ОН)(СН3)2. Атомы водорода легко замещаются при галогенировании, нитрозировании и т.п. Действием хлора и щелочи ацетон превращается в хлороформ, который взаимодействуя с ацетоном с образованием хлорэтона (СН3)2С(ОН)СС13, применяемого как антисептик. Ацетон окисляет вторичные спирты в присутствии алкоголятов А1 до кетонов (реакция Оппенауэра):
![]()
Вступает в альдольную конденсацию с образованием диацетонового спирта (СН3)2С(ОН)СН2СОСН3, а также в кротоновую конденсацию с образованием окиси мезитила (СН3)2С=СНСОСН3, форона (СН3)2С=СНСОСН=С(СН3)2 и мезитилена. В присутствии сильной минеральной кислоты ацетон алкилирует фенол с образованием дифенилолпропана (бисфенола ацетона) (НОС6Н4)2С(СН3)2, присоединяет цианид-ион с образованием ацетонциангидрина (CH3)2C(OH)CN. При пиролизе (700°С) ацетон образуются кетен СН2=С=О и метан. В промышленсти ацетон получают преимущественно так назеваемым кумольным способом одновременно с фенолом из бензола и пропилена через изопропилбензол (кумол) по схеме, рассмотренной подробнее выше:
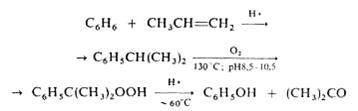
Ацетон - широко применяемый растворитель органических веществ, в первую очередь нитратов и ацетатов целлюлозы; благодаря сравнительно малой токсичности он используется также в пищевой и фармацевтической промышленности; ацетон служит также сырьем для синтеза уксусного ангидрида, кетена, диацетонового спирта, окиси, мезитила, метилизобутилкетона, метилметакрилата, дифенилолпропана, изофорона и многих других соединений. Для ацетон Твсп. -20°С, Тсамовоспл. 500°С; КПВ 2,15-13,00%. Ацетон при вдыхании накапливается в организме. Т.к. выводится из организма медленно, возможны хронические отравления. ПДК 200 мг/м3.
6. Заключение
В процессе производства применяются токсичные вещества, оказывающие вредное влияние на обслуживающий персонал и окружающую среду. Это исходные компоненты для синтеза – серная кислота и гидроперекись изопропилбензола и основные продукты синтеза – ацетон и фенол.
Серная кислота - чрезвычайно агрессивное вещество. Она поражает дыхательные пути, кожу, слизистые оболочки, вызывают затруднение дыхания, кашель, нередко - ларингит, трахеит, бронхит и так далее. ПДК аэрозоля серной кислоты в воздухе рабочей зоны 1,0 мг/м3, в атмосферном воздухе 0,3 мг/м3 (максимальная разовая) и 0,1 мг/м3 (среднесуточная). Поражающая концентрация паров серной кислоты. 0,008 мг/л (экспозиция 60 мин), смертельная 0,18 мг/л (60 мин). Класс опасности 2. Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов хим. и металлургических производств, содержащих оксиды S, и выпадать в виде кислотных дождей. Изопропилбензол - при ингаляции вызывает острые и хронические поражения кроветворных органов (костного мозга, селезенки)
Фенол вызывает нарушение функций нервной системы, дыхания и кровообращения, раздражает слизистые оболочки дыхательных путей и глаз, вызывает ожоги при попадании на кожу. ПДК в атмосферном воздухе 0,003 мг/м3, в воздухе рабочей зоны 0,3 мг/м3, в воде водоемов рыбохозяйственного и хозяйственно-бытового пользования 0,001 мг/л. ЛД50 427 мг/кг (мыши, внутрижелудочно). Ацетон при вдыхании накапливается в организме. Т.к. выводится из организма медленно, возможны хронические отравления. ПДК 200 мг/м3. Для снижения экологической напряжённости производства применяется регенерация серной кислоты, позволяющая снизить отходы производства. В цехах должны быть реализованы эффективные системы приточно-вытяжной вентиляции для обеспечения безопасных условий работы персонала.
Химическая наука и химическая промышленность в настоящее время являются одними из ведущих отраслей, которые обеспечивают научно технический прогресс в обществе. Интенсивный рост данной отрасли требует создания мощной производственной базы в области основных растворителей и крупнотоннажных реагентов.
В данной работе приведён критический анализ разнообразных способов получения ацетона. Выбрана оптимальная технологическая схема. Проведена оценка экологической безопасности производства.
Благодаря тому, что в рассмотренной схеме серная кислота работает в замкнутом цикле, снижается экологическая напряжённость процесса. Таким образом в курсовой работе разработана технологическая модель являющаяся прогрессивной, экономически эффективной и экологически безопасной.
7. Список использованных источников
1. Кутепов А. М., Бондарева Т. И., Беренгартен М. Г. Общая химическая технология. М.: Высшая школа, 1990. 520 с.
2. Общая химическая технология / Под ред. И. П. Мухлёнова М.: Высшая школа, т 1, 2. 1984, 419 с.
3. Расчёты химико-технологических процессов / Под ред. И. П. Мухлёнова, изд М.: Химия. 1982, 245 с.
4. Бесков С. Д. технологические расчёты. М.: Высшая школа,1966, 519 с.
Похожие работы
... , необходимо отметить, что во многих случаях следует комплексно использовать их, дополняя совершенствованием организации и управления производством, расширением и углублением научных исследований в области химической технологии, а также улучшением проектной деятельности соответствующих организаций. Новым мощным средством повышения эффективности ряда производств следует считать внедрение атомной ...
... сопряжения с системами иных функциональных назначений, смежных с используемой (если таковые имеются) [3]. ОБЗОР ИСПОЛЬЗУЕМЫХ И ПРОЕКТИРУЕМЫХ СИСТЕМ Наибольшее распространение системы химического мониторинга получили в химической технологии при моделировании технологических процессов. Так, производства нитроглицерина, тротила, аммиачной селитры, фосфатов и других крупнотоннажных продуктов ...
... приводят к гибели наркоманов? Какие факторы способствуют высокой смертности? Причины: травмы - в дорожных происшествиях, по неосторожности, в "разборках"; передозировки; отравления некачественными наркотиками; заболевания - сепсис, пневмония, хроническая печеночная недостаточность. Факторы, способствующие высокой смертности: высокая вовлеченность в криминальные отношения, невнимательность и ...
... наркотической зависимости. Возвращение к людям, к обществу - это совместный труд врачей, семьи, педагогов. Полный курс лечения от наркомании и токсикомании состоит из четырех этапов. Первый этап - нейтрализация ядов в организме человека. С помощью специальных растворов и медикаментов осуществляется выведение и избавление организма от наркотических веществ. Процесс выведения наркотиков особенно ...



0 комментариев