Навигация
Методы очистки золей: диализ, электродиализ, ультрафильтрация
6. Методы очистки золей: диализ, электродиализ, ультрафильтрация
Диализ. Очищаемый золь, заливают в сосуд, дном которого служит мембрана, задерживающая коллоидные частицы или макромолекулы и пропускающая молекулы растворителя и низкомолекулярные примеси. Внешней средой, контактирующей с мембраной, является растворитель. Низкомолекулярные примеси, концентрация которых в золе или макромолекулярном растворе выше, переходят сквозь мембрану во внешнюю среду (диализат). Очистка идет до тех пор, пока концентрации примесей в золе и диализате не станут близкими по величине. Если обновлять растворитель, то можно практически полностью избавиться от примесей.
Такое использование диализа целесообразно, когда цель очистки – удаление всех низкомолекулярных веществ, проходящих сквозь мембрану. Однако в ряде случаев задача может оказаться сложнее – необходимо освободиться только от определенной части низкомолекулярных соединений в системе. Тогда в качестве внешней среды применяют раствор тех веществ, которые необходимо сохранить в системе. Именно такая задача ставится при очистке крови от низкомолекулярных шлаков и токсинов (солей, мочевины и т.п.). Если удалять подряд все низкомолекулярные компоненты крови, то начинается разрушение клеток, что, в свою очередь, может привести к гибели организма.
Электродиализ. Очистку от электролитов можно значительно ускорить действием приложенной разности потенциалов (электромиграцией). Такой метод очистки называется электродиализом. Его используют для очистки различных биологических объектов (растворы белков, сыворотка крови и пр.).
Ультрафильтрация. Ультрафильтрация – метод очистки коллоидных систем путем продавливания дисперсионной среды вместе с низкомолекулярными примесями через ультрафильтры. Ультрафильтрами служат мембраны того же типа, что и для диализа. В мешочек из ультрафильтра наливают очищаемый золь или раствор высокомолекулярного вещества. К золю прилагают давление, избыточное по сравнению с атмосферным. Дисперсионную среду обновляют, добавляя к золю чистый растворитель.
Ультрафильтрация используется не только для удаления низкомолекулярных компонентов смеси, но и для концентрирования систем и разделения веществ с различной молекулярной массой. Этим методом очищают сточные воды, отделяют культуральные жидкости от продуктов микробиологического синтеза, концентрируют биологически активные вещества: белки, ферменты, антибиотики и т.д.
В последние годы ультрафильтрация наряду с диализом получила распространение в клинике для обработки крови. Этот метод применяется для выведения из организма токсических веществ и, если это необходимо, для удаления избытка жидкости.
II. Раздел «Оптические свойства коллоидных систем»
1. Оптические свойства коллоидных систем. Опалесценция и флуоресценция
Прохождение света через коллоидную систему вызывает три оптических эффекта: поглощение, отражение и рассеивание лучей. Поглощение свойственно всем системам, тогда как отражение более характерно для грубодисперсных систем (эмульсий и суспензий), где размер частиц больше, чем длина волны облучения. Поэтому, в отличие от молекулярных и ионных растворов, которые не имеют поверхности раздела фаз и оптически однородны, коллоидные растворы рассеивают свет.
Это проявляется опалесценцией в виде голубоватого матового свечения при освещении боковым светом. При пропускании параллельного пучка света через коллоидный раствор наблюдается конус рассеянного света – эффект Тиндаля. По способности рассеивать свет можно определять концентрацию коллоидных частиц в растворе - метод нефелометрии.
Опалесценция (светорассеяние) наблюдается только тогда, когда длина световой волны больше размера частицы дисперсной фазы. Если длина световой волны много меньше диаметра частицы, происходит отражение света, проявляющееся в мутности.
Рассеянный свет имеет ту особенность, что он распространяется во всех направлениях. Интенсивность рассеянного света в различных направлениях различна.
С опалесценцией внешне сходна, флуоресценция, характерная для истинных растворов некоторых красителей. Она заключается в том, что раствор при наблюдении в отраженном свете имеет иную окраску, чем в проходящем, и в нем можно видеть такой же конус Тиндаля, что и в типичных коллоидных системах. Однако по существу это совершенно различные явления. Опалесценция возникает в результате рассеяния света, при этом длина волны рассеянного света та же, что и падающего. Флуоресценция же представляет собой внутримолекулярное явление, заключающееся в селективном поглощении молекулой вещества светового луча и в трансформировании его в световой луч с другой, большей длиной волны.
2. Поглощение света дисперсными системами. Зависимость поглощения от концентрации. Закон Бугера-Ламберта-Бера
В 1760г. Ламберт, а еще ранее Бугер установили следующую зависимость между интенсивностью прошедшего света и толщиной среды, через которую этот свет прошел:
![]() ,
,
где ![]() - интенсивность прошедшего света;
- интенсивность прошедшего света;
![]() - интенсивность падающего света;
- интенсивность падающего света;
![]() - коэффициент поглощения;
- коэффициент поглощения;
![]() - толщина поглощающего света.
- толщина поглощающего света.
Согласно закону Бугера-Ламберта – каждый последующий слой поглощает ту же долю проходящего света, что и предыдущий.
Бер показал, что коэффициент поглощения растворов с абсолютно бесцветным и прозрачным растворителем пропорционален молярной концентрации ![]() растворенного вещества:
растворенного вещества: ![]() .
.
Вводя значение молярного коэффициента поглощения ![]() в уравнение Бугера-Ламберта, получим закон Бугера-Ламберта-Бера:
в уравнение Бугера-Ламберта, получим закон Бугера-Ламберта-Бера:
![]() ,
,
Закон устанавливает зависимость интенсивности прошедшего света от толщины слоя и концентрации растворенного вещества.
Логарифмируя уравнение, получим:
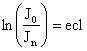 ,
,
где 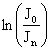 - оптическая плотность раствора
- оптическая плотность раствора ![]() ;
;
![]() - светопропускание раствора.
- светопропускание раствора.
Если ![]() , тогда
, тогда ![]() ,
,
Если ![]() , раствор не адсорбирует света, тогда закон Бугера-Ламберта-Бера имеет вид:
, раствор не адсорбирует света, тогда закон Бугера-Ламберта-Бера имеет вид:
![]() ,
,
т.е. интенсивность прошедшего света будет равна интенсивности падающего.
Молярный коэффициент поглощения ![]() зависит от длины волны адсорбирующего света, температуры и природы растворенного вещества и растворителя и не зависит от концентрации раствора.
зависит от длины волны адсорбирующего света, температуры и природы растворенного вещества и растворителя и не зависит от концентрации раствора.
Закон Бугера-Ламберта-Бера приложим для золей высокой дисперсности, если слой жидкости не слишком толст, а концентрация раствора не слишком большая.
Для металлических золей уравнение светопоглощения должно учитывать дисперсность системы:
![]() ,
,
Похожие работы
... «мицелла» и «мицеллярный раствор». Эти термины были использованы им для обозначения систем, образованных нестехиометрическими соединениями в водной среде. Основная заслуга в становлении коллоидной химии как науки принадлежит Т. Грэму. Как уже отмечалось выше, именно этому ученому принадлежит идея введения термина «коллоид», производного от греческого слова «kolla», обозначающего «клей». Занимаясь ...
... Расстояние, пройденное веществом по сорбенту, прямо пропорционально растворимости данного вещества в пропускаемом растворителе. Даёт возможность полностью разделять вещества, входящие в состав разделяемой смеси. Коллоидная химия Дисперсные системы – это системы, состоящие из множества частиц одной фазы (дисперсной), распределённых в объёме другой фазы – дисперсионной. Дисперсионная среда ...
... и многое другое, без чего немыслима сама жизнь. Все человеческое тело – это мир частиц, находящихся в постоянном движении строго по определенным правилам, подчиняющимся физиологии человека. Коллоидные системы организмов обладают рядом биологических свойств, характеризующих то или иное коллоидное состояние: 2.2 Коллоидная система клеток. С точки зрения коллоидно-химической физиологии ...
... металлов с белками, нуклеиновыми кислотами, липидами. Её практическое применение связано с синтезом фарамакологических препаратов, действие которых обусловленно комплексными ионами металлов. Биоорганическая Химия Изучает связь между строениями органических веществ и их биологическими функциями, использующих в основном методы органической и физической химии, а также физики и математики. ...
0 комментариев