Навигация
100 · 36,5
V конц. HCl= ——————— = 91,1 (4)
34,18 .1,172
Отмерили с помощью цилиндра объемом 100 мл расчетный объем концентрированной соляной кислоты и влили через воронку в термостойкую мерную колбу объемом 1000 мл, предварительно наполненную на 1/3 дистиллированной водой. Содержимое колбы перемешали круговыми движениями в одном направлении. Затем объем раствора довели до метки дистиллированной водой. Закрыли колбу пробкой и перемешали, переворачивая колбу вниз-вверх. /10/
2.2Приготовили 0,1Н раствор соляной кислоты для титрования
Приготовление вели из 1Н раствора соляной кислоты путем разбавления в 10 раз. Отмерили с помощью цилиндра 100 мл приготовленного в п. 2.1. 1Н раствора соляной кислоты. В термостойкую мерную колбу объемом , 1000 мл предварительно наполненную на 1/2 дистиллированной водой, влили через воронку 100 мл 1Н раствора соляной кислоты и перемешали содержимое круговыми движениями. Затем довели до метки дистиллированной водой, закрыли пробкой и перемешали, переворачивая колбу вверх-вниз. /10/
2.3 Определили точную концентрацию приготовленных растворов соляной кислоты
Определение проводили с помощью отстандартизированного раствора 0,1Н гидроксида натрия методом обратного титрования. Пипеткой отобрали 10 мл отстандартизированного раствора 0,1Н гидроксида натрия и перенесли в коническую мерную колбу для титрования объемом 100 мл, добавили 20 мл дистиллированной воды (отмерили мерным цилиндром ) 2-3 капли индикатора (фенолфталеина). Титрование проводили приготовленным в п.2.2. 0,1Н раствором соляной кислоты до обесцвечивания розовой окраски. Титрование повторили 3 раза. Нормальность соляной кислоты определили по формуле 5:
10. 0,1
NHCL = ——— = 0,09 (5),где
11,1
N HCL- нормальность соляной кислоты
V HCL- объем 0,1Н соляной кислоты, пошедшей на титрование, 11,1 мл (За окончательный результат принимается среднее арифметическое значение из серии проведенных параллельных титрований.
V1=11 мл, V2=11,2 мл, V3=11,1мл)
V NaOH- объем аликвоты гидроксида натрия, равный 10 мл
NNaOH- нормальность отстандартизированного раствора гидроксида натрия (использовали 0,1Н раствор)
Для оценки концентрации 1Н соляной кислоты предварительно осуществили разведение в мерной колбе в 10 раз. Полученным раствором заполнили бюретку объемом 25 мл.
Титрование проводили аналогично методике, указанной в п. 2.3. Нормальность соляной кислоты определяется по формуле 6:
10 . 0,1 .10
N HCL= ——————— =0,867(6) ,где
11,53
NHCL- нормальность соляной кислоты, получили равной
VNaOH- объем аликвоты гидроксида натрия, равный 10 мл,
NNaOH - нормальность отстандартизированного раствора гидроксида натрия (использовали 0,1Н раствор)
VHCL - объем разведенной 0,1Н соляной кислоты, пошедший на титрование, 11,53 мл (За окончательный результат принимается среднее арифметическое значение из серии проведенных параллельных титрований.V1=11,5 мл, V2=11,4 мл, V3=11,7мл)
R - число разведений, равное 10.
Содержимое колб перенесли в склянки (бутыли) объемом 1000 мл, оформили этикетки, закрыли пробками. /10/
2.4 Приготовление 25% раствор хлорида бария (BaCL2)
Для приготовления раствора использовали ВаС12х2Н2О W=99,5% ,ГОСТ 4108-72, дата производства 08.09.2003, срок хранения 3года.
Взвесили 62,5 г хлорида бария на технических весах с точностью до 0,01 г. В термостойкую колбу объемом 250 мл налили около 100 мл дистиллированной воды и постепенно через воронку пересыпали навеску хлорида бария. Затем с помощью стеклянной палочки, а также круговыми движениями в одном направлении, перемешали содержимое колбы. Полученному раствору дали отстояться, отфильтровали и слили в склянку (бутыль) объемом 300 мл. /5, 8,10,20/
2.5 Приготовление 3% оксалата аммония ((NH4) C2O4)
Для приготовления использовалиС2Н8N2О4 х Н2О,W=99,8%, ГОСТ 5712-78, дата изготовления 24.05.83, срок хранения 3 года
Взвесили 7,5 г оксалата аммония на технических весах с точностью до 0,01 г. В термостойкую колбу объемом 250 мл налили 100 мл дистиллированной воды и постепенно через воронку пересыпали навеску оксалата аммония. Затем с помощью стеклянной палочки, или круговыми движениями в одном направлении, перемешали содержимое колбы. Полученному раствору дали отстояться, отфильтровали и слили в склянку (бутыль) объемом 300 мл. /5,8,10,20/
2.6 Приготовление 16 % раствора карбоната натрия (Na2CO3)
Для приготовления использовали безводный Na2CO3, W=99,8%, ГОСТ 83-63, 1968
Взвесили 95,2 г карбоната натрия на технических весах с точностью до 0,01 г. В термостойкую колбу объемом 1000 мл налили 300 мл дистиллированной воды и, в несколько приемов (4-5) постепенно при перемешивании стеклянной палочкой добавили карбонат натрия. Затем прилили оставшиеся 200 мл дистиллированной воды. Процесс растворения карбоната натрия в воде является экзотермическим, поэтому его проводили при охлаждении водой на водяной бане. Полученному раствору дали отстояться, отфильтровали и слили в склянку объемом 500 мл.
Похожие работы
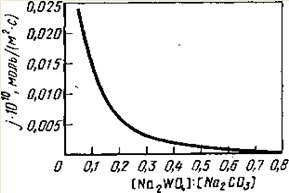
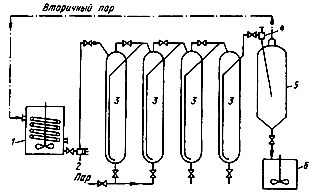
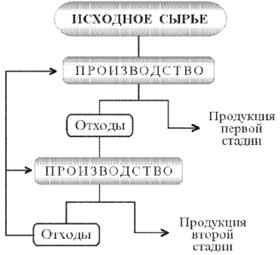
... в автоклавах, щелочи (для вольфрамита) и кислотами. Это позволяет интенсифицировать автоклавно-содовое разложение вольфрамовых концентратов, сократить расходы соды и в ряде случаев проводить процесс в одну стадию. Последнее увеличивает производительность автоклавов[4]. 4. Получение вольфрамового ангидрида 4.1 Переработка растворов вольфрамата натрия Растворы в, содержащие 60—150 г/л ...
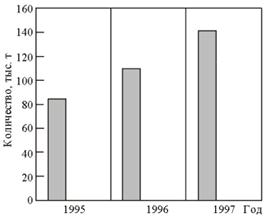
... отходам производства. В докладе «О состоянии окружающей природной среды Российской Федерации в 1997 году» Государственного комитета Российской Федерации по охране окружающей среды отмечается, что на начало 1997 г. на предприятиях различных отраслей промышленности накоплено 1431,7 млн. т токсичных отходов. За 1997 г. на промышленных предприятиях РФ образовалось 89,4 млн т токсичных отходов, из ...

0 комментариев