Навигация
Методика выполнения лабораторной работы
3. Методика выполнения лабораторной работы.
По заданному количеству карбоната натрия и по соотношению исходных реагентов в загрузке (избыток гидроксида кальция в мольном отношении составляет 1; 1-1,5) рассчитали объемы растворов исходных реагентов.
V(Na2CO3)=100мл, p(Na2CO3)=1,170 г/мл
mр-ра(Na2CO3)=100. 1,170=117г
mв-ва(Na2CO3)=117. 0,16=18,72г
nв-ва(Na2CO3)=18,72: 106=0,177моль
nв-ва(Са(ОН)2)=0,177. 1,5=0,265 моль
m(Са(ОН)2)=74. ,265=19,60г
1000мл _________ 312,03
Х _________ 19,60
V(Са(ОН)2)=62,82мл
В фарфоровый стакан-каустицер залили рассчитанный объем исходного 16%-го содового раствора и поместили каустицер в термостат, нагретый до температуры 800 С. Одновременно в термостат поместили колбу с рассчитанным объемом свежеприготовленного известкового молока и нагрели до 800С. Затем вынули колбу с известковым молоком и в течении 3-5 мин небольшими порциями ввели в каустицер с содовым раствором содержимое колбы. После добавления последней порции включили мешалку в каустицере. Каустификацию проводили в течении 50мин.
Содержимое каустицера количественно перенесли на фильтровальную установку последовательно в несколько приемов. Осадку дали отстояться на фильтре в течении 5-7 минут. Количественно перенесли весь влажный осадок в предварительно взвешенную чашку Петри.
mосадка=57г
Взяли навеску осадка 2 грамма, поместили на предварительно взвешенное часовое стекло. Затем количественно перенесли навеску на фильтр воронки для простого фильтрования. Смыли часовое стекло и стеклянную палочку от остатков осадка 2-3 раза дистиллированной водой. Промывали осадок до получения 200мл промывных вод.
4. Обработка результатов.
1) Определение в фильтрате содержание гидроксида натрия, карбоната натрия, гидроксида кальция как указано в п. 14.
2)
V1=26,2 мл
V2=24,85 мл
V1- V2= 26,2-24,85=1,35 мл
С(Na2CO3)=6,203г/л
С(Са(ОН)2)=0 г/л ,т.к. (Са(ОН)2) прореагировал полностью в процессе каустификации.
V3=0мл
С(NаОН)=4,68 г/л
m(NаОН)в осадке= 0,267г
m(Na2CO3)в осадке= 0,354г
m(Са(ОН)2)в осадке= 0г
3) Определение в промывных водах содержание гидроксида натрия, карбоната натрия, гидроксида кальция как указано в п. 14.
V1=1,8 мл
V2=1,55 мл
V1- V2= 1,8-1,55=0,25 мл
С(Na2CO3)= 0,119г/л
С(Са(ОН)2)=0 г/л ,т.к. (Са(ОН)2) прореагировал полностью в процессе каустификации.
V3=0мл
С(NаОН)= 0,09 г/л
m(NаОН)в осадке= 0,513 г
m(Na2CO3)в осадке= 0,6783 г
m(Са(ОН)2)в осадке= 0г
Рассчитываем степень каустификации :
(mNaOH) факт
Х = ——————— ∙ 100 % = 40%
(mNaOH) теор.
(mNaOH) факт = 0,267 +0,513= 0,78г
(mNaOH) теор. = 1,957г
Список используемой литературы
1. Практикум по общей химической технологии. /Под ред. И.П. Мухленова. – М.: Высшая школа, 1973.– 423с.
2. С.А.Крашенинников. Технология соды. – М.: Химия, 1988. – 378с.
3. Химическая технология. /Под ред. И.А. Кнунянца. – М.: Большая Российская энциклопедия, 1988.том 2 – 1335с.
4. Химическая энциклопедия. /Под ред. Ю.А.Золотова, В.А.Кабанова и др. – М.: Большая российская энциклопедия, 1988.том 3. – 1268с.
5. Краткий химический справочник. /Под ред. В.А.Рабиновича. – М.: Химия, 1977. – 376с.
6. Правила по технике безопасности и производственной санитарии при работе в химических лабораториях медицинских учебных заведений. /Министерство здравоохранения СССР. – М.: 1982. – 58с.
7. Инструкция по охране труда в химической лаборатории.
8. Большой энциклопедический словарь. Химия./Под ред. И.А. Кнуянца. – М.: Большая Российская энциклопедия,1998 – 790с.
9. Государственный стандарт Союза ССР. Реактивы. Кальция окись. Технические условия ГОСТ 8677-76, издание официальное. Государственный комитет СССР по стандартам Москвы с – 8.
10. Методические указания к лабораторно–практическим занятиям по аналитической химии (Курс количественного анализа). /Под ред. А.С. Квач. – К.: КГМУ, 1991. – 58с.
11. Неорганическая химия. /Под ред. Н.Н.Павлова. – М.: Высшая школа, 1993. –
12. Основы химической технологии. /Под ред. И.П. Мухленова. – М.: Высшая школа, 1991.
13. Первые в ряду элементов. /Под ред. А.А.Николаева. – М.: Просвещение, 1983.
14. Журнал "Химическая промышленность". № 8, 1993.
15. Химия в действии. /Под ред. А.М. Фримант. – М.: Мир, 1994.
16. Неорганическая химия. /Под ред. Э.Г.Оганесян. – М.: Высшая школа, 1984.
17. Курс аналитической химии. Качественный анализ. /Под ред. А.П. Крешкова. –М.: Химия, 1982.
18. Физическая и коллоидная химия. /Под ред. К.И.Евстратовой. – М.: Высшая школа, – 1990. –487с.
19. Аналитическая химия. /Под ред. В.П.Васильева. – М.: Высшая школа, – 1989. –384с.
20. Справочник химика . Основные свойства неорганических и органических соединений. /Под ред. !!!!. – М.: Химия, 1964 том 2. – 1165с.
Похожие работы
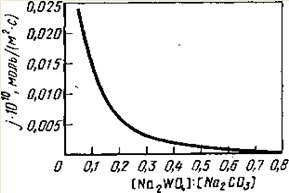
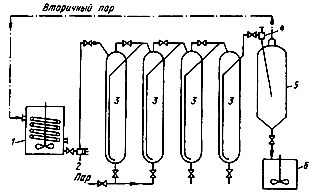
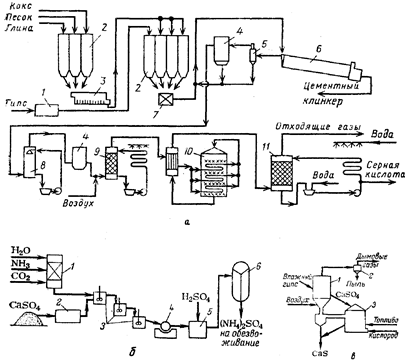
... в автоклавах, щелочи (для вольфрамита) и кислотами. Это позволяет интенсифицировать автоклавно-содовое разложение вольфрамовых концентратов, сократить расходы соды и в ряде случаев проводить процесс в одну стадию. Последнее увеличивает производительность автоклавов[4]. 4. Получение вольфрамового ангидрида 4.1 Переработка растворов вольфрамата натрия Растворы в, содержащие 60—150 г/л ...
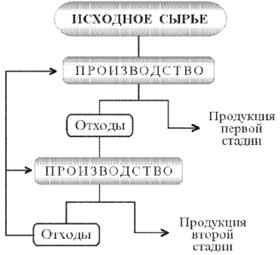
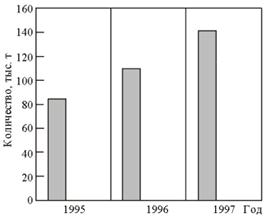
... отходам производства. В докладе «О состоянии окружающей природной среды Российской Федерации в 1997 году» Государственного комитета Российской Федерации по охране окружающей среды отмечается, что на начало 1997 г. на предприятиях различных отраслей промышленности накоплено 1431,7 млн. т токсичных отходов. За 1997 г. на промышленных предприятиях РФ образовалось 89,4 млн т токсичных отходов, из ...

0 комментариев