Навигация
АМИЛАЗЫ. СТРОЕНИЕ, ФУНКЦИИ
1.2 АМИЛАЗЫ. СТРОЕНИЕ, ФУНКЦИИ
Амилазы (от лат. amylum - крахмал), ферменты класса гидролаз, катализирующие гидролиз крахмала, гликогена и др. родственных олиго- и полисахаридов, гл. обр. по 1,4![]() глюкозидной связи (см., напр., схему в ст. О-Гликозидгидролазы). При приготовлении дрожжевого теста дрожжи разлагают крахмал с помощью амилазы до ди- и трисахаридов, которые потом используются в жизнедеятельности, образуя в результате спирт, углекислый газ (CO2) и другие метаболиты, которые придают хлебу специфический вкус и «поднимают» тесто. Однако, это длительный процесс, поэтому в современных технологиях амилаза используется как одно из важных составляющих специальной добавки, ускоряющий процесс брожения. Бактериальная амилаза используется в стиральных порошках для разложения крахмала, присутствующего в белье.
глюкозидной связи (см., напр., схему в ст. О-Гликозидгидролазы). При приготовлении дрожжевого теста дрожжи разлагают крахмал с помощью амилазы до ди- и трисахаридов, которые потом используются в жизнедеятельности, образуя в результате спирт, углекислый газ (CO2) и другие метаболиты, которые придают хлебу специфический вкус и «поднимают» тесто. Однако, это длительный процесс, поэтому в современных технологиях амилаза используется как одно из важных составляющих специальной добавки, ускоряющий процесс брожения. Бактериальная амилаза используется в стиральных порошках для разложения крахмала, присутствующего в белье.
![]() А. (мол. м. 50 тыс.) участвует в гидролизе сахаров, содержащих подряд три или более остатков глюкозы. Расщепление связей может происходить между любыми остатками глюкозы, причем остатки моносахаридов в месте разрыва имеют конфигурацию
А. (мол. м. 50 тыс.) участвует в гидролизе сахаров, содержащих подряд три или более остатков глюкозы. Расщепление связей может происходить между любыми остатками глюкозы, причем остатки моносахаридов в месте разрыва имеют конфигурацию![]() аномеров.
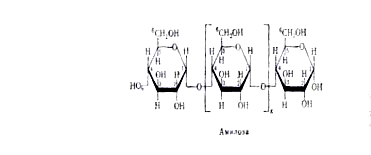
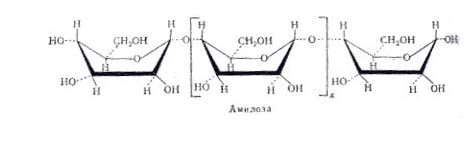
аномеров.![]() А. превращает амилозу крахмала в глюкозу и мальтозу. Находящийся в крахмале амилопектин, содержащий в молекуле 1,6
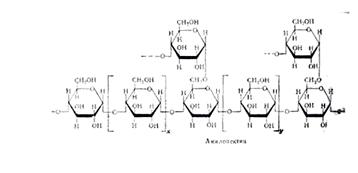
А. превращает амилозу крахмала в глюкозу и мальтозу. Находящийся в крахмале амилопектин, содержащий в молекуле 1,6![]() связи, полностью не гидролизуется - остается разветвленный полисахарид, т. наз. "остаточный декстрин".
связи, полностью не гидролизуется - остается разветвленный полисахарид, т. наз. "остаточный декстрин".![]() А. обладает слабокислыми св-вами. Ионы Са2+ и Cl- активируют ее. Присутствует во всех тканях животных и растений, а также в микроорганизмах. По каталитич. активности ферменты из разных источников значительно отличаются друг от друга.
А. обладает слабокислыми св-вами. Ионы Са2+ и Cl- активируют ее. Присутствует во всех тканях животных и растений, а также в микроорганизмах. По каталитич. активности ферменты из разных источников значительно отличаются друг от друга.![]() А. слюны, поджелудочной железы и слизистой кишечника участвуют в переваривании пищи,
А. слюны, поджелудочной железы и слизистой кишечника участвуют в переваривании пищи,![]() А. печени расщепляет гликоген.
А. печени расщепляет гликоген.
![]() А. (мол. м. 50-200 тыс.) последовательно отщепляет остатки
А. (мол. м. 50-200 тыс.) последовательно отщепляет остатки![]() мальтозы от невосстанавливающего конца цепи полисахаридов. Под действием
мальтозы от невосстанавливающего конца цепи полисахаридов. Под действием![]() А. из амилозы образуется мальтоза, а из амилопектина также "остаточный декстрин". Содержится
А. из амилозы образуется мальтоза, а из амилопектина также "остаточный декстрин". Содержится![]() А. в солоде.
А. в солоде.
![]() А. (экзо-1,4
А. (экзо-1,4![]() глюкозидаза; мол. м. 50-100 тыс.) последовательно отщепляет концевые остатки
глюкозидаза; мол. м. 50-100 тыс.) последовательно отщепляет концевые остатки![]() D-глюкозы от невосстанавливающих концов цепей полисахаридов с образованием
D-глюкозы от невосстанавливающих концов цепей полисахаридов с образованием![]() D-глюкозы. Способна также расщеплять 1,6
D-глюкозы. Способна также расщеплять 1,6![]() связь, если следующие за ней моносахариды соединены в положениях 1 и 4. Содержится в плесневых грибах. Определение активности А. используют в диагностич. целях, в частности для идентификации гликогеноза. А. (в т. ч. иммобилизованные) применяют в пром-сти:
связь, если следующие за ней моносахариды соединены в положениях 1 и 4. Содержится в плесневых грибах. Определение активности А. используют в диагностич. целях, в частности для идентификации гликогеноза. А. (в т. ч. иммобилизованные) применяют в пром-сти:![]() А.-для "осахаривания" крахмала,
А.-для "осахаривания" крахмала,![]() А.-для произ-ва глюкозы.
А.-для произ-ва глюкозы.
Функции. Амилаза - гидролитический фермент - разлагает крахмал и гликоген до мальтозы. Амилаза образуется преимущественно в слюнных железах и поджелудочной железе, поступает затем соответственно в полость рта или просвет двенадцатиперстной кишки и участвует в переваривании углеводов пищи. В сыворотке крови выделяют соответственно панкреатический и слюнной изоферменты амилазы. Значительно более низкой амилазной активностью обладают также такие органы как яичники, фаллопиевы трубы, тонкий и толстый кишечник и печень. Фермент выводится почками. Следовательно, увеличение сывороточной активности амилазы приводит к повышению активности амилазы в моче. Амилаза может образовывать крупные по размеру комплексы с иммуноглобулинами и другими белками плазмы, поэтому не проходит через почечные клубочки, поэтому содержание ее в сыворотке возрастает, в моче наблюдается нормальная активность амилазы.
Слюна содержит значительное количество амилазы — фермента, принимающего участие в переваривании углеводов, а также ферменты, расщепляющие белки. Все они активны только при щелочной или нейтральной реакции среды. Поэтому кислый желудочный сок прекращает их действие. Но, тем не менее, их влияние продолжается некоторое время в желудке, потому что пищевой комок не сразу пропитывается желудочным соком.
Слюна обладает бактерицидными (убивающими микробы) свойствами. Она предупреждает развитие кариеса зубов благодаря присутствию в ней фермента лизоцима. У человека слюноотделение связано и с речевой функцией: слюна обеспечивает во время речи увлажнение слизистой оболочки ротовой полости (установлено, что слюноотделение сопровождает даже акт письма). В течение суток выделяется от 0,5 л до 2 л слюны.
Похожие работы
... реакция подчинена закону действующих масс и рассматривается в свете теории Михаэлиса – Ментона, то есть V=K(F) V- скорость реакции K- константа скорости F- концентрация фермента (Смотри приложение 4). На графике показано соотношение скорости реакции и концентрации субстрата. В восходящей части гиперболы при низких концентрациях ...
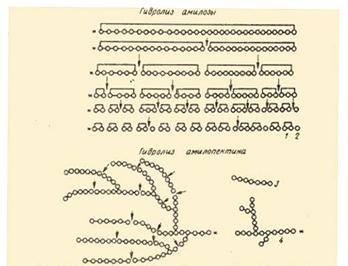
... предельным декстрином в конце гидролиза амилопектина амилазой слюны был найден тетрасахарид, солодовой амилазы – паноза, т. е устойчивым к расщеплению в первом случае были две a-1,4-глюкозидные связи, во втором – лишь одна. На рис. Представлена схема действия a-амилаз на амилозу и амилопектин по Бернфельду. Рис.2 Действие a-амилазы на амилозу и амилопектин по Бернфельду.1 – мальтоза; 2 – ...
... межпредметных связей между биологией и химией.Следует использовать знания,полученные учениками при изучении неорганической химиии в курсе 8-9 классов (темы:”Кислород,оксиды,горение”, ”Водород”, ”Кислоты,соли,основания”, “Строение вещества”). Формирование понятие “фермент” в курсе “Общая биология” Дальнейшее знакомство с ферментами ученики продолжают в курсе “Общая биология”. Здесь происходит ...
... (белка). Для целей определения ферментов могут быть использованы не только измерение поглощения света, но также измерения флюоресценции - спектрофлюорометрические методы. Такое определение активности фермента в ряде случаев по чувствительности превосходит спектрофотометрические методы на целый порядок величины. Некоторые коферменты и субстраты обладают сильной флюоресценцией. НАД и НАДФ в ...
0 комментариев