Навигация
ЭКСПЕРЕМЕНТАЛЬНАЯ ЧАСТЬ
2. ЭКСПЕРЕМЕНТАЛЬНАЯ ЧАСТЬ
Исследование воздействия внешних факторов на амилазу слюны
1. Специфичность амилазы слюны
Методика приготовления разбавленной слюны:
Прополоскать рот два раза дистиллированной водой для удаления остатков пищи. Взять в рот 20 мл. дистиллированной воды, держать её во рту около двух минут. полученную жидкость слить в стакан или колбу. Жидкость представляет собой раствор слюны, содержащий амилазу-фермент.
Ход работы:
В 2 пробирки добавить по 20 капель раствора крахмала, в 3-ю- 20 капель раствора сахарозы.
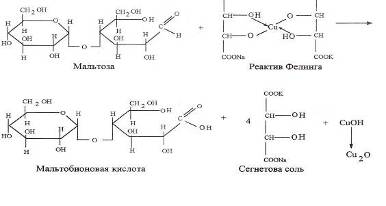
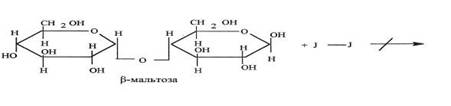
В первую пробирку налить 10 капель дистиллированной воды, во вторую и в третью пробирки добавить по 10 капель разведенной слюны. Содержимое пробирок перемешать встряхиванием и поместить пробирки в водяную баню с температурой 37-40’ С. Через пять минут пробы разделить пополам и проделать реакции с йодом (для чего добавить в каждую пробирку по 1 капле раствора йода в йодистом калии) и с фелинговой жидкостью (добавить по 5 капель фелинговой жидкости).
Результаты отражены в таблице 1
Таблица 1
№ пробирки | Субстрат | фермент | Реакция с йодом | Реакция с Фелинговой жидкостью | |
До | После | ||||
1 | крахмал |
| бесцветный. | Сине-фиолетовое окрашивание (со временем исчезает) | - |
2 | крахмал | амилаза |
| Бесцветный | - |
3 | сахароза | амилаза | бесцветный | Голубой оттенок (со временем не исчезает) | - |
Реакция гидролиза крахмала на субстрате с участием фермента амилаза прошла, о чем свидетельствует положительная проба с Фелинговой жидкостью, и отрицательная с реактивом Люголя. Амилаза катализирует гидролиз крахмала, сахароза не катализирует гидролиз крахмала.
Реакция гидролиза крахмала с участием амилазы
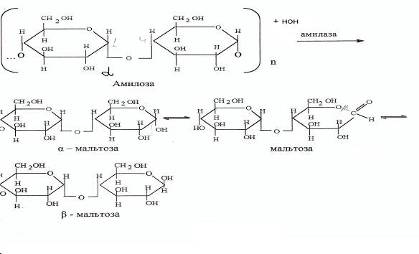
Обнаружение продуктов гидролиза крахмала
Реакция с жидкостью Фелинга:
Реакция с реактивом Люголя:
2.Влияние ингибиторов и активаторов на активность амилазы.
Ход работы:
В 3 пробирки налить по 5-10 капель разведенной слюны. В первую пробирку добавляют 1 каплю хлористого натрия (NaCl), во вторую -1каплю раствора сернокислой меди (CuSO4), в третью – 1 капли воды. Затем в каждую пробирку прилить по 5 капель раствора крахмала. Все три пробирки на 2-3 минуты поместить в водяную баню при температуре 37-40 С. Добавит в каждую пробирку по 1 капле раствора йода в йодистом калии.
Результаты отражены в таблице 2
Таблица 2
№ пробирки | Фермент | Эффектор | Субстрат | Реакция с йодом | наблюдения |
1 | Амилаза | NaCl | Крахмал | Синие окрашивание | Прозрачн. |
2 | Амилаза | CuSO4 | Крахмал | Синие окрашивание | Синие окрашивание |
3 | Амилаза | Н2О | Крахмал | Синие окрашивание | Бледно-голубое окрашивание |
Вывод: Ионы Cl активирует амилазу, ионы Сu – ингибиторы для всех ферментов, т.к. типичный металл вызывает денатурацию белка. То есть по скорости обесцвечивания крахмала с реактивом Люголя, NaCl является активатором, а CuSO4 –ингибитором.
3. ЗАКЛЮЧЕНИЕ
Благодаря своей функции разнообразные ферменты обеспечивают быстрое протекание в организме огромного числа химических реакций. В настоящее время выделены и изучены сотни ферментов известно, что живая клетка может содержать до 1000 различных ферментов, каждый из которых ускоряет ту или иную химическую реакцию.
Важно подчеркнуть, что изучение ферментов имеет огромное значение для любой фундаментальной и прикладной области биологии, а также для многих практических отраслей химической, пищевой и фармацевтической индустрии, занятых приготовлением катализаторов, антибиотиков, витаминов и многих других биологически активных веществ, используемых в народном хозяйстве и медицине
Роль ферментов в жизнедеятельности животных, растений и микроорганизмов колоссальна. Благодаря каталитической функции разнообразные ферменты обеспечивают быстрое протекание в организме и вне его огромного числа химических реакций.
В природе под каталитическим воздействием ферментов осуществляются процессы гидролиза, фосфоролиза, переноса различных групп (метильные радикалы, остатки фосфорной кислоты и т. д.), окисления и восстановления, расщепления и синтеза, изомеризации и т. п. В частности они катализируют реакции синтеза и распада нуклеиновых кислот, участвуют в процессе пищеварения, катализируют реакции анаэробного окисления и процесс свертывания крови. Практически все химические преобразования в живом веществе протекают с помощью ферментов. Естественно поэтому, что каталитическая функция ферментов лежит в основе жизнедеятельности любого организма
Разобрав поставленную задачу, изучение специфичности амилазы можно выделить следующее выводы:
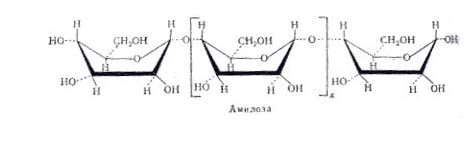
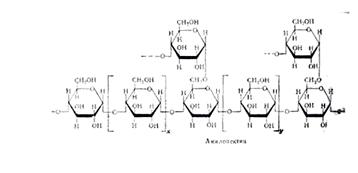
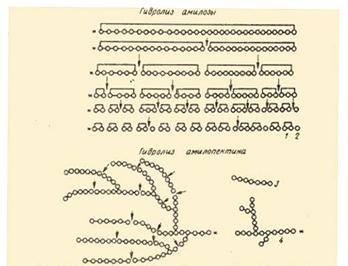
1. Фермент амилазы слюны, осуществляет гидролиз крахмала до мальтозы. Амилаза действует на -1,4 -гликозидные связи, расщепляют амилозу внутри её цепи, в результате чего с большой скоростью образуются низкомолекулярные продукты гидролиза - нормальные -декстрины. Их дальнейший гидролиз даёт мальтозу, мальтотриозу и глюкозу. Расщепление -1,4-глюкозидных связей в амилозе носит случайный характер и подчиняется закону статистического распределения продуктов реакции. Расщепление более мелких фракций на последнем этапе амилоза носит уже не случайный характер - действие фермента направлено лишь на определённые -1,4-гликозидные связи. В конечном счёте - амилазы превращают амилозу в мальтозу и глюкозу. Уменьшение количества крахмала является признаком ферментативной реакции.
2. Амилазы специфичны у разных видов организмов. Физиологическая роль их состоит в мобилизации запасов полисахаридов в клетках (например, при прорастании семян).
3. Ионы тяжелых металлов, сильные кислоты, щелочи, спирт блокируют деятельность фермента, являются ингибиторами. Хлорид - ионы повышают активность фермента, являются активаторами. Активаторы стимулируют действие ферментов, но в отличие от коферментов не принимают участия в реакции.
4. СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
Учебная и научная литература
1.Березов Т.Т., Коровкин Б.Ф. Биологическая химия: Учебник.- М.: Медицина, 1990.- с.115
2. Основы биохимии: Учебник для студ. биол. спец. ун-тов/под ред. А.А. Анисимова.- М.: Выс.шк., 1986. - с.133-140
3. Комов, В.П. Биохимия / В.П. Комов, В.Н. Шведова. – М.: Дрофа, 2004. – 640 с.
Материалы локальной сети Интернет
4.Официальный сайт WWW.ХИМИК.RU канд. техн. наук А.Г. Пестов.2008г.
5. Портал фундаментального химического образования в Росси www.chem.msu.ru - Ю.Б. Филиппович, А.С. Коничев, 2009г.
6.Сайт химического факультета МГУ ttp://www.chem.msu.su/rus/journals/chemlife/welcome.html В.П. Комов, В.Н. Шведова.2009г.
7. Мультимедийный учебник «1С: Репетитор. Химия» http://repetitor.1c.ru/online/disp.asp?10;3
- Учебное пособие для студентов химических и биологических специальностей педвузов.– Н. Новгород: НГПУ, 2008г. – 59 с.
8. Портал научно-популярной химической информации www.alhimik.ru; - Г.Е. Яковлева. Ферменты в клинической биохимии.2009г.
Похожие работы
... реакция подчинена закону действующих масс и рассматривается в свете теории Михаэлиса – Ментона, то есть V=K(F) V- скорость реакции K- константа скорости F- концентрация фермента (Смотри приложение 4). На графике показано соотношение скорости реакции и концентрации субстрата. В восходящей части гиперболы при низких концентрациях ...
... предельным декстрином в конце гидролиза амилопектина амилазой слюны был найден тетрасахарид, солодовой амилазы – паноза, т. е устойчивым к расщеплению в первом случае были две a-1,4-глюкозидные связи, во втором – лишь одна. На рис. Представлена схема действия a-амилаз на амилозу и амилопектин по Бернфельду. Рис.2 Действие a-амилазы на амилозу и амилопектин по Бернфельду.1 – мальтоза; 2 – ...
... межпредметных связей между биологией и химией.Следует использовать знания,полученные учениками при изучении неорганической химиии в курсе 8-9 классов (темы:”Кислород,оксиды,горение”, ”Водород”, ”Кислоты,соли,основания”, “Строение вещества”). Формирование понятие “фермент” в курсе “Общая биология” Дальнейшее знакомство с ферментами ученики продолжают в курсе “Общая биология”. Здесь происходит ...
... (белка). Для целей определения ферментов могут быть использованы не только измерение поглощения света, но также измерения флюоресценции - спектрофлюорометрические методы. Такое определение активности фермента в ряде случаев по чувствительности превосходит спектрофотометрические методы на целый порядок величины. Некоторые коферменты и субстраты обладают сильной флюоресценцией. НАД и НАДФ в ...
0 комментариев