Навигация
История открытия и нахождение в природе
1. История открытия и нахождение в природе
Впервые титан был открыт в виде двуокиси титана в 1789г. английским ученым МакГрегором. Позднее многим исследователям удавалось получить металлический титан. К числу таких исследователей можно отнести Берцелиуса (1825г.), получившего металлический титан восстановлением фтортитаната калия натрием; Нильсона и Петерсона (1887г.), которые получили металлический титан восстановлением четыреххлористого титана натрием; Муассана (1895г.), получившего металл содержащий около 2% примесей, восстановлением двуокиси титана углеродом с последующим рафинированием, и многих других. Однако, долгое время титан ошибочно считали непригодным для использования в качестве конструкционного материала, так как получаемый металл являлся хрупким из-за большого количества примесей. только в начале этого столетия был получен титан с новыми свойствами, которые ставят его в ряд с самыми ценными материалами.[7,c.6]
Титан является перспективным металлом не только благодаря его качествам, но и потому, что запасы его в земной коре очень велики.[7,c.7]
Титан очень распространен в природе; его содержание в земной коре составляет 0,61% (масс.), т.е. выше, чем содержание таких широко используемых в технике металлов, как медь, свинец и цинк. [1,c.648]
Минералы, содержащие титан, находятся в природе повсеместно. В настоящее время насчитывается около восьмидесяти минералов, в состав которых входит титан.[7,c.7] Важнейшими из них являются: титаномагнетиты FeTiO3×nFe3O4, ильменит , сфен CaTiSiO5 и рутил TiO2.[1,c.648]
Месторождения титана разделяются на россыпные и коренные. Почти все используемые для производства титана руды добываются из россыпных месторождений. Месторождения ильменита встречаются во многих странах. Производство ильменитовых концентратов, которые обычно содержат 50-60% двуокиси титана и применяются в основном для получения пигментов титана, в последние годы достигло почти 2,5 млн. т в год. Самым крупным производителем ильменитовых руд являются США, на долю которых приходится 31% всего выпуска, Канада – 22%, Австралия – 21% и Норвегия – 13% (1986г.).
Рутил представляет собой более высококачественное сырье для получения титана, однако его месторождения обнаружены в немногих странах. Крупнейшими поставщиками рутиловых концентратов являются в настоящее время Австралия, США и Индия.
В России для производства титана используют ильменит и титаномагнетит, запасы которых исчисляются десятками миллионов тонн. Основным спутником титана в этих рудах является железо, которое находится в низ в виде закиси, находящейся в химическом соединении или механической смеси с двуокисью титана.[7,c8]
2. Получение
Имеется целый ряд способов получения металлов из руд, содержащих их окислы. К ним прежде всего относится прямое восстановление окислов углем или другими восстановителями. Однако применение такого способа часто оказывается невозможным вследствие высокой прочности окисла или вследствие образования твердых растворов получаемого металла с восстановителем или примесями, имеющимися в сырье. В таком случае приходится применять более сложные схемы, например перевод металла в другое соединение (хлорид, нитрид, фторид и т.д.), а затем очистку этого соединения от примесей и получение элемента путем восстановления другим элементом или электролизом. Выбор технологической схемы получения элемента зависит от многих факторов. Прежде всего исходят из оценки физико-химических свойств соединений и степени сложности аппаратурного оформления.
Прежде чем рассматривать возможные схемы получения чистого металла, следует остановиться на технологии получения титана вообще. Высокая активность этого металла и резкое снижение его свойств при небольшом повышении содержания примесей – это те качества, наличие которых обусловливает применение особых технологических приемов в процессе его производства. Первая стадия производства титана заключается в рудно-восстановительной плавке, которая проводится с целью обогащения исходного материала окисными соединениями титана. Во всех последующих стадиях производства взаимодействие титана и его соединений с кислородом нежелательно.
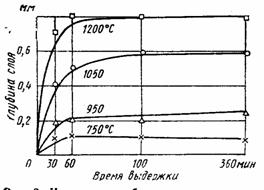
Титан растворяет такие элементы, как азот, водород и углерод. С последним он образует стойкие карбиды, а в присутствии кислорода – оксикарбиды. Все эти примеси снижают пластичность металла и делают его непригодным к употреблению в качестве конструкционного материала. При высоких температурах титан может реагировать с CO, CO2,H2O и даже с такими прочными соединениями, как SiO2, Al2O3, и MgO. Поэтому получение титана и его плавка должны осуществляться или в среде инертного газа, или в вакууме. Реактор для получения титана не может быть футерован обычными футеровочными материалами. В случае осуществления процесса получения титана в металлическом реакторе появляются трудности, связанные со способностью титана сплавляться с большинством металлов. Температура плавления титана составляет около 1660˚С, но при сплавлении с железом, никелем, медью и некоторыми другими металлами он образует эвтектический сплав с температурой плавления около 1000˚С и даже несколько ниже. Следовательно, необходим такой процесс, при котором образующийся титан быстро охлаждается и, следовательно, предотвращается процесс его взаимодействия с материалом реактора.
При любом способе получения титана должны быть учтены его указанные выше свойства. В результате этого производство титана всегда будет носить специфический характер и будет более сложно, чем, например, производство таких металлов, как алюминий или магний.
Восстановление двуокиси титана углем. При взаимодействии двуокиси титана с углеродом можно предположить протекание следующих реакций:

Термодинамические расчеты показывают, что прежде всего будут протекать реакции карбидообразования. Процесс карбидообразования протекает через образование ряда промежуточных окислов, которые в свою очередь образуют непрерывный ряд твердых растворов с карбидом титана. Повышение температуры или понижение давления сдвигает равновесие системы в сторону замещения кислорода углеродом. При давлении ниже 10 мм рт. ст. и при температуре выше 1300˚С достигается полное обескислороживание твердого раствора и наблюдается выделение металлического титана вследствие реакции:
![]()
Восстановление двуокиси титана водородом. Процесс взаимодействия двуокиси титана с молекулярным водородом протекает до образования низших окислов.
При температуре 1050˚С двуокись титана восстанавливается водородом до Ti3O5 по реакции:
![]()
Выше этой температуры образуется смесь окислов Ti3O5 и Ti2O3.
Восстановление двуокиси титана кремнием, натрием, магнием и кальцием. Наиболее сильным восстановителем является кальций. Окись кальция легко растворяется в разбавленных минеральных и органических кислотах и поэтому может быть сравнительно легко удалена после процесса восстановления. Также восстановление двуокиси титана может проводиться гидридом кальция, алюминием и с помощью электролиза.
Получение титана из его фтористых солей, карбидов и нитридов. Двуокись титан, а также титановые руды могут быть переработаны в любые другие соединения титана, например в хлориды, фториды, сульфиды, нитриды, карбиды и др. Чистый металл из этих соединений может быть получен восстановлением, электролизом или комбинированным способом.
Для электролиза из фтористых соединений наиболее приемлемым является гексафтортитанат калия (K2TiF4). Он сравнительно легко получается, имеет хорошую электропроводность и низкое давление пара, стоек на воздухе. Электролиз может быть осуществлен в среде расплавленных солей под защитой инертного газа. При этом можно получить сравнительно чистый металл, содержащий 99,9% титана. Сложность аппаратурного оформления и высокая стоимость сырья являются существенными недостатками этого способа, препятствующими его развитию.
Использование карбидов и нитридов титана для получения чистого металла так же, как и смесей, содержащих металлический титан, связано с применением электрорафинирования. Это двухстадийный способ, отличающийся тем, что в качестве исходного сырья для первичной стадии процесса восстановления могут быть использованы титаносодержащие шлаки или даже концентраты руд. В качестве восстановителя используют уголь, алюминий, магний, кальций и другие элементы и соединения. В зависимости от вида восстановителя и условий протекания процесса получают металлический титан, низшие оксиды, карбид, нитрид, оксикарбид или оксикарбонитрид титана в смеси с другими соединениями и элементами.[7,c.11]
Магнийтермический способ получения титана. Для получения титана также применяется магний, при этом в качестве побочного продукта получается хлористый магний, являющийся сырьем для производства магния. Вместе с тем при производстве магния побочным продуктом является хлор, который необходим для получения четыреххлористого титана, поэтому производство магния и титана обычно совмещают на одном заводе.
Титан выпускают в виде губки или слитков, которые затем на других заводах перерабатывают на лист, профили, трубы, поковки и другие полуфабрикаты. Технологическая схема получения титана состоит из шести основных переделов.[7,c.29]
При промышленном получении титана руду или концентрат переводят в диоксид титана TiO2, который затем подвергают хлорированию. Однако даже при 800-1000˚С хлорирование протекает медленно. С достаточной для практических целей скоростью оно протекает в присутствии углерода, связывающего кислород в основном в СО:
TiO2 + 2Cl2 + 2C = TiCl4 + 2CO
Получающийся хлорид титана(IV) восстанавливают магнием:
TiCl4 + 2Mg = Ti + 2MgCl2
а образующуюся смесь подвергают нагреванию в вакууме. При этом магний и его хлорид испаряются и осаждаются в конденсаторе. Остаток – губчатый титан – переплавляют, получая компактный ковкий металл.
Примеси кислорода, азота, углерода резко ухудшают механические свойства титана, а при большом содержании превращают его в хрупкий материал, непригодный для практического использования. Поскольку при высоких температурах титан реагирует с названными неметаллами, его восстановление проводят в герметичной аппаратуре в атмосфере аргона, а очистку и переплавку – в высоком вакууме.[1,c.648]
Для получения небольших количеств титана высокой чистоты применяют иодидный метод.
Иодидный метод относится к термическому разложению. Исходный металл в виде порошка нагревается до 100-200˚С с небольшим количеством иода в герметическом аппарате. В аппарате натянуты титановые нити, нагреваемые электрическим током до 1300-1500˚С. Титан (но не примеси) образует с иодом летучий иодид TiI4, который разлагается на раскаленных нитях. Выделяющийся чистый титан осаждается на них, а иод образует с исходным металлом новые порции иодида; процесс идет непрерывно до переноса всего металла на титановые нити:
![]()
Похожие работы
... при больших значениях пленки получаются несплошные, легко отделяющиеся от поверхности металла (железная окалина) в результате возникающих внутренних напряжений. Поведение титана и его сплавов в различных агрессивных средах Реакции титана со многими элементами происходят только при высоких температурах. При обычных температурах химическая активность титана чрезвычайно мала и он практически ...
... были обнаружены в парах. Известен ряд двойных карбидов галлия различного состава с марганцем, железом, платиной, ниобием, хромом и некоторыми другими металлами. Соединения галлия с кремнием и бором не получены. 6. ОСОБЫЕ СВОЙСТВА ЭЛЕМЕНТА И ЕГО СОЕДИНЕНИЙ, ИХ ПРИМЕНЕНИЕ. Не стоит брать этот элемент в руки - тепла человеческого тела достаточно, чтобы этот серебристый мягкий (его можно резать ...
... и азота образуются нитриды железа состава Fe2N и Fe4N (N2+6Fe=Fe2N+Fe4N). При нагревании азота с ацетиленом C2H2 может быть получен цианистый водород HCN (N2+C2H2=2HCN). Из сложных неорганических соединений азота наибольшее значение имеют азотная кислота HNO3, ее соли нитраты, а также азотистая кислота HNO2 и ее соли нитриты. Получение В промышленности азот получают из воздуха. Для этого воздух ...
... выше сохранность поголовья на 4,6%, прирост живой массы на 7,0%, ниже затраты корма и себестоимость 1 кг прироста. Выводы На основании проведенных исследований по изучению влияния разных дозировок комплексоната титана на продуктивность цыплят-бройлеров можно сделать следующие выводы: Оптимальной дозой кормовой добавки комплексоната титана в рационе цыплят-бройлеров является 0,1 мг/кг живой ...
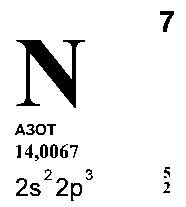
0 комментариев