Навигация
6. Соединения титана
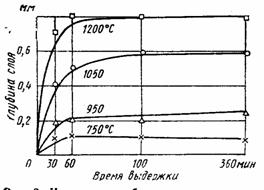
При высокой температуре титан соединяется с галогенами, кислородом серой, азотом и другими элементами. На этом основано применение сплавов титана с железом (ферротитана) в качестве добавки к стали. Титан соединяется с находящимися в расплавленной стали азотом и кислородом и этим предотвращает выделение последних при затвердевании стали, - литье получается однородным и не содержит пустот.
Соединяясь с углеродом, титан образует карбид. Из карбидов титана и вольфрама с добавкой кобальта получают сплавы, по твердости приближающиеся к алмазу.
Диоксид титана TiO2 – белое тугоплавкое вещество, нерастворимое в воде и разбавленных кислотах. Это – амфотерный оксид, но как основные, так и кислотные свойства у него выражены слабо. [1,c.650]
Встречается в природе как рутил (кубическая сингония), реже в виде анатаза (тетрагональная сингония) и брукита (ромбическая сингония). В рутиле каждый ион Ti4+ окружен шестью ионами О2-, а каждый ион О2- окружен тремя ионами Ti4+. В остальных двух кристаллических формах непосредственные соседи ионов те же.
Совершенно чистый диоксид титана бесцветен. В природе он обычно загрязнен окисями железа и поэтому окрашен.
Совершенно не растворяется в воде и в разбавленных кислотах. В теплой концентрированной серной кислоте он растворяется медленно с возможным образованием сульфита титана Ti(SO4)2, который, однако, нельзя выделить в чистом виде из-за легкости его перехода вследствие гидролиза в сульфит титанила (TiO)SO4. Эта растворимая в холодной воде соль при нагревании также гидролизуется с образованием H2SO4 и гидратированного диоксида титана, так называемой β-титановой или метатитановой кислоты. Легкость с которой происходит этот гидролиз, говорит о слабых основных свойствах гидроокиси титана. Сульфат титана дает с сульфатами щелочных металлов (которые добавляются к используемой для растворения диоксида титана серной кислоте) двойные соли, например K2[Ti(SO4)3], более устойчивые к гидролизу, чем простые сульфаты.
Гидроокиси и карбонаты щелочных металлов осаждают из растворов сульфатов на холоду студенистый гидратированный диоксид титана, так называемую ά-титановую кислоту, отличающуюся от β-титановой более высокой реакционной способностью (так, например ά-титановая кислота растворяется в щелочах, в которых β-титановая нерастворима). Гидроокись четырехвалентного титана, или собственно титановую кислоту Ti(OH)4, нельзя выделить, в этом она похожа на кремниевую и оловянную кислоты. ά- и β- титановые кислоты, представляющие собой более или менее дегидратированные производные гидроокиси титана(IV), полностью сравнимы с ά- и β-оловянными кислотами.
Нейтральный или подкисленный раствор сульфата титанила, а также других солей титана окрашивается перекисью водорода в темно-оранжевый цвет (реакция обнаружения перекиси водорода). Аммиак осаждает из этих растворов пероксотитановую кислоту H4TiO5 желто-коричневого цвета, имеющую формулу Ti(OH)3O-OH.[2,c.635]
Применяется TiO2 при изготовлении тугоплавких стекол, глазури, эмали, жароупорной лабораторной посуды, а также для приготовления белой масляной краски, обладающей высокой кроющей способностью (титановые белила).
Сплавлением TiO2 с BaCO3 получают титанат бария BaTiO3. Эта соль имеет очень высокую диэлектрическую проницаемость и, кроме того, обладает способностью деформироваться под действием электрического поля. Кристаллы титаната бария применяются в электрических конденсаторах высокой емкости и малых размеров, в ультразвуковой аппаратуре, в звукоснимателях, в гидроакустических устройствах.[1,c.650]
Хлорид титана(IV) TiCl4, получаемый тем же способом, что и SiCl4, представляет собой бесцветную жидкость с температурой кипения 136˚C и температурой плавления -32˚С, гидролизующуюся водой с образованием TiO2 и 4HCl. С галогенидами щелочных металлов хлорид титана(IV) дает двойные хлориды, содержащие комплексный ион [TiCl6]2-. Фторид титана(IV) TiF4 выделяют в виде белого порошка с температурой плавления 284˚С; он также легко гидролизуется и образует с HF гексафторотитановую(IV) кислоту H2TiF6, подобную гексафторкремниевой кислоте.
Безводный хлорид титана(III) TiCl3 получают в виде фиолетового порошка пропусканием паров TiCl4 вместе с Н2 через медную трубку, нагретую примерно до 700˚C. В виде водного раствора (фиолетового цвета) его получают восстановлением TiCl4 в соляной кислоте при помощи цинка или электролитически. Так же получают и сульфат титана(III). Из водного раствора хлорида титана(III) выкристаллизовывается фиолетовый гексагидрат TiCl3·6H2O.
Хлорид титана(II) TiCl2, окрашенный в черный цвет, получают термическим разложением TiCl3 при 700˚С в атмосфере водорода:
![]()
Бесцветный водный раствор этого хлорида быстро окисляется на воздухе, при этом он вначале окрашивается в фиолетовый цвет, а затем снова становится бесцветным вследствие образования сначала соединения Ti(III), а затем соединения Ti(IV).[2,c.636]
Карбонитриды, оксикарбиды и оксинитриды титана. Обнаружено, что характер зависимости растворения тугоплавких фаз внедрения (ТФВ) – карбидов, нитридов и оксидов титана – от состава коррелирует с изменением степени металличности связей Ti-Ti в ряду TiC-TiN-TiO, а именно: с увеличением степени металличности фаз в этом направлении их химическая стойкость в HCl и H2SO4 снижается, а в HNO3 – растет. Поскольку карбиды, нитриды и монооксид титана характеризуются полной взаимной растворимостью, то можно ожидать, что и при взаимодействии их твердых растворов с кислотами будет проявляться аналогичная закономерность.
Однако имеющиеся в литературе сведения о зависимости степени растворения TiCxOy и TiNxOy от состава в минеральных кислотах плохо согласуются с этим предположением. Так, растворимость TiCxOy (фракция <56 мкм) в конц. HCl отсутствует вообще (20˚C, 6 ч и 100˚С, 3 ч), а в H2SO4 – отсутствует при 20˚C (6 ч), но монотонно возрастает от 3% (TiC0.30O0.78) до 10% (TiC0.86O0.12) при 100˚C (3 ч). Степень растворения TiCxOy (фракция 15-20 мкм) в 92%-ной H2SO4 (100˚C, 1 ч), напротив, уменьшается с ростом содержания углерода от 16% (TiC0.34O0.66) до 2%(TiC0.78O0.22). Степень растворения TiCxOy в конц. HCl (d=1,19 г/см) в тех же условиях достигает 1-2%, не обнаруживая ,однако, какой-либо зависимости от состава фазы. Степень растворения TiNxOy в конц. HNO3 – низкая (2,5-3,0%) и не зависит от состава оксинитрида (20˚C, 6 ч). С другой стороны степень растворения TiNxOy в HNO3 в тех же условиях варьирует в очень широких пределах: от 98% для TiC0.88O0.13 до 4,5% для TiC0.11O0.82. Трудно сказать что-либо определенное о характере зависимости степень растворения – состав карбонитрида титана в соляной и серной кислотах. Степень растворения TiCxOy в HCl очень мала (0,3%) и не зависит от состава карбонитрида (60˚C, 6 ч). Однако в конц. H2SO4 она на порядок выше (3,0-6,5%) и характеризуется минимумом (2%) для образца состава TiC0.67O0.26.
Полученные экспериментальные данные позволяют утверждать, что характер зависимости растворения TiCxNy, TiCxOy и TiNxOy от состава в HCl, H2SO4 и HNO3 является вполне определенным и, более того, подобным установленному ранее для TiCx, TiNx и TiOx. Это означает, что и причины качественно различного хода этих зависимостей в HCl и H2SO4, с одной стороны, и в HNO3 с другой, должны быть общими для всех исследованных соединений системы TI-C-N-O, т.е. определяться степенью металличности связи Ti-Ti и пассивирующей способностью образующихся продуктов взаимодействия.[4]
Титанаты лития и цинка Li2ZnTi3O8 и Li2Zn3Ti4O12 имеют кубическую шпинельную структуру с различным распределением катионов по позициям. Установлено, что эти соединения являются твердыми литийпроводящими электролитами. В Li2ZnTi3O8 катионы лития и титана упорядочены в октаэдрических позициях в соотношении 1:3, половина атомов лития и цинк статистически распределены по тетраэдрическим позициям: (Li0.5Zn0.5)[Li0.5Ti1.5]O4. Кристаллохимическая формула Li2Zn3Ti4O12 может быть записана как (Zn)[Li2/3Ti4/3]O4. На основе анализа ИК- и КР-спектров предложен иной способ распределения атомов лития и цинка в структуре данных шпинелей: литий имеет тетраэдрическую координацию, а цинк и титан – октаэдрическую. Отмечено также сильное искажение октаэдров TiO6: так, в Li2Zn3Ti4O12 окружение ионов Ti4+ ,близко к пяти координационному. Невысокая ионная проводимость этих титанатов при повышенных температурах объясняется тетраэдрической координацией атомов лития.
На примере галидных шпинелей Li2MX4 (M=Mg2+,Mn2+,Fe2+; X=Cl-,Br-) установлено, что катионный состав и распределение атомов лития по позициям оказывает сильное влияние на величину электропроводности. Так как в структуре шпинели нет общих граней между одинаковыми катионными позициями, в ионном переносе участвует несколько различных позиций. Высокие значения ионной проводимости в хлоридных шпинелях наблюдались в результате разупорядочения структуры соединений, связанного с переходом атомов лития при повышенных температурах из тетраэдрических позиций 8а в свободные октаэдрические позиции 16с. При этом шпинельная структура превращалась в структуру типа NaCl. Информативным методом исследования разупорядочения структуры хлоридных шпинелей явилось изучение КР-спектров соединений при высоких температурах.[5]
Литература
1. Н.Л. Глинка. Общая химия – Л.: Химия, 1981, - 720 с.;
2. К. Неницеску. Общая химия – М.: Мир, 1968, 816 с.;
3. Н.С. Ахметов. Общая и неорганическая химия – М.: Высшая школа, 743с.;
4. В.А. Жиляев, А.П. Штин. "Взаимодействие карбонитридов, оксикарбидов и оксинитридов титана с концентрированными минеральными кислотами", Журнал неорганической химии, т.48, №8(Август 2003), с.1402;
5. И.А. Ленидов, Л.А. Переляева и др. "Исследование разупорядочения шпинелей Li2xZn2-3xTi1+xO4(x=0.33, 0.5) методом спектроскопии комбинационного рассеяния света: Корреляция с ионной проводимостью", Журнал неорганической химии,т.48, №11(Ноябрь 2003), с.1841;
6. М.М. Годнева, Д.Л. Мотов, Химия подгруппы титана – Л.: Наука, 1980, - 175с.;
7. Сергеев В.В., Галицкий Н.В и др. Металлургия титана – М.: Металлургия, 1971, - 320с.;
8. Под ред. Галицкого Б.А. Титан и его сплавы в химическом машиностроении – М.: Машиностроение, 1968 – 340с.
Похожие работы
... при больших значениях пленки получаются несплошные, легко отделяющиеся от поверхности металла (железная окалина) в результате возникающих внутренних напряжений. Поведение титана и его сплавов в различных агрессивных средах Реакции титана со многими элементами происходят только при высоких температурах. При обычных температурах химическая активность титана чрезвычайно мала и он практически ...
... были обнаружены в парах. Известен ряд двойных карбидов галлия различного состава с марганцем, железом, платиной, ниобием, хромом и некоторыми другими металлами. Соединения галлия с кремнием и бором не получены. 6. ОСОБЫЕ СВОЙСТВА ЭЛЕМЕНТА И ЕГО СОЕДИНЕНИЙ, ИХ ПРИМЕНЕНИЕ. Не стоит брать этот элемент в руки - тепла человеческого тела достаточно, чтобы этот серебристый мягкий (его можно резать ...
... и азота образуются нитриды железа состава Fe2N и Fe4N (N2+6Fe=Fe2N+Fe4N). При нагревании азота с ацетиленом C2H2 может быть получен цианистый водород HCN (N2+C2H2=2HCN). Из сложных неорганических соединений азота наибольшее значение имеют азотная кислота HNO3, ее соли нитраты, а также азотистая кислота HNO2 и ее соли нитриты. Получение В промышленности азот получают из воздуха. Для этого воздух ...
... выше сохранность поголовья на 4,6%, прирост живой массы на 7,0%, ниже затраты корма и себестоимость 1 кг прироста. Выводы На основании проведенных исследований по изучению влияния разных дозировок комплексоната титана на продуктивность цыплят-бройлеров можно сделать следующие выводы: Оптимальной дозой кормовой добавки комплексоната титана в рационе цыплят-бройлеров является 0,1 мг/кг живой ...
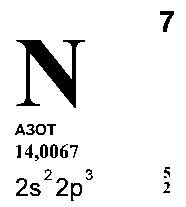
0 комментариев