Навигация
Вода как растворитель. Свойства воды
4. Вода как растворитель. Свойства воды
Как известно, жизнь зародилась в воде и по-прежнему остается тесно связанной с водой. Поэтому физико-химические свойства воды имеют фундаментальное значение для процессов жизнедеятельности.
Вода и метан
Уникальные свойства воды H2O становятся очевидными при сравнении с метаном (CH4). Обе молекулы одинаковы по массе и размерам. Тем не менее температура кипения воды на 250оС выше по сравнению с температурой кипения метана. В результате вода на поверхности Земли находится в жидком, а метан — в газообразном состоянии. Высокая точка кипения воды является следствием высокой теплоемкости испарения, что в свою очередь обусловлено неравномерным распределением электронной плотности в молекуле воды. Молекула воды имеет форму тетраэдра, в центре которого расположен атом кислорода. Две вершины тетраэдра заняты свободными электронными парами атома кислорода (зеленого цвета), а остальные две — атомами водорода. Поэтому связи H—О—H расположены под углом друг к другу. Кроме того, из-за высокой электроотрицательности атома кислорода связь О—H полярна (см. с. 14). Атомы водорода несут частичный положительный заряд около +0,4, а атом кислорода — частичный отрицательный заряд около -0,6, т. е, молекула воды представляет собой электрический диполь. Поэтому каждая молекула воды, подобно маленькому магниту, притягивает к себе за счет образования водородных мостиков (Б) еще четыре молекулы. При испарении воды разрушение зтих многочисленных водородных связей требует больших затрат энергии. Молекулы метана неполярны, не являются диполями и относительно слабо взаимодействуют друг с другом. Вследствие этого жидкий метан испаряется при очень низких температурах.
Структура воды и льда
Биполярное строение молекул воды благоприятствует образованию водородных связей. При этом каждая молекула проявляет свойства как донора, так и акцептора водорода. Поэтому у воды в жидком состоянии многие молекулы связаны между собой водородными «мостиками» (связями). причем образующиеся ассоциаты находятся в динамическом равновесии. Часто образуются тетраэдрические структуры, так называемые "кластеры" воды. При понижении температуры доля кластеров возрастает вплоть до начала кристаллизации. При нормальном атмосферном давлении вода кристаллизуется при 0oC. при этом большинство молекул воды оказываются встроенными в гексагональную решетку . Поскольку в твердом состоянии расстояние между молекулами в среднем больше, чем в жидкости, плотность льда меньше по сравнению с плотностью воды. Это свойство воды очень важно в экологическом отношении хотя бы потому, что зимой на поверхности водоемов образуется слой льда и они редко промерзают до дна.
Гидратация
В отличие от большинства других жидкостей вода является идеальным растворителем для диссоциирующих веществ. В электрическом поле того или иного иона молекулы воды образуют регулярные структуры в соответствии с зарядом иона. Эта гидратная оболочка экранирует ион от ионов противоположного заряда. Вода имеет высокую константу диэлектрической проницаемости (78), т.е. в воде электростатическое притяжение двух противоположно заряженных ионов снижается примерно в 80 раз (1/78). Молекулы воды, находящиеся во внутренней сфере непосредственно около иона, практически иммобилизованы (привязаны к этому иону) и перемещаются вместе с центральным ионом. Хорошо растворимы в воде и нейтральные соединения с несколькими гидроксильными группами, такие, как глицерин или сахара, поскольку они способны образовывать водородные связи с молекулами растворителя.
5. Возникновение тока в гальваническом элементе. Электродвижущая сила. Преимущества и недостатки гальванических элементов
Два металла, погруженные в растворы их солей, соединенные между собой электролитическим ключом, образуют гальванический элемент.
Возникновение электрического тока гальваническом элементе обусловлено разностью электродных потенциалов взятых металлов и сопровождается глубокими химическими превращениями, протекающими на электродах. Покажем это на примере работы медно - цинкового элемента.
На цинковом электроде, опущенном в раствор сульфата цинка, происходит окисление атомов цинка в ионы (растворение цинка):
Zn - 2e = Zn2+
электроны при этом поступают во внешнюю цепь. На медном электроде, погруженном в раствор сульфата меди, происходит восстановление ионов металла в атомы:
Cu2+ + 2e = Cu
Одновременно часть ионов SO42- переходит через “электролитический мостик” в сосуд с раствором сульфата цинка,
Суммарное уравнение процесса получим:
Zn - 2e = Zn2+ анодный процесс
Cu2+ + 2e = Cu катодный процесс
Zn + Cu2+ = Zn2+ + Cu суммарный процесс
Электрод, на котором протекает процесс окисления, называется анодом (в нашем случае цинковый),а электрод, на котором протекает процесс восстановления - катодом (медный). Гальванический элемент можно записать в виде краткой электрохимической схемы:
(-) Zn | Zn2+ || Cu2+ | Cu (+) в ионном виде или
(-) Zn / ZnSO4//CuSO4 / Cu (+) в молекулярном
Обычно анод записывается слева, а катод - справа.
Необходимым условием работы гальванического элемента возникновение разности потенциалов на его электродах.
При вычислении напряжения гальванического элемента принято потенциал с меньшей алгебраической величиной вычитать из потенциала с большей алгебраической величиной; другими словами, из потенциала положительного полюса (катода) вычитать потенциал отрицательного (анода)
x = j oкатод - joанод
Напряжение медно - цинкового гальванического элемента определяется
x = j o Cu /Cu2+ - jo Zn/Zn2+= (+0,34) - ( - 0,76 ) = +1,10 в
Положительный знак напряжения определяет направление самопроизвольного протекания реакции слева направо. Как известно, движущей силой химической реакции является убыль энергии Гиббса. Для реакций, осуществляемых в условиях гальванического элемента, работа, производимая системой, равна работе электрического тока:
A = IUt = QU
где I - ток в цепи;
U - падение напряжения;
t - время;
Q- количество электричества
В случае, если реакция протекает обратимо в равновесных условиях, U = E (напряжение элемента равно напряжению на электродах при токе равном нулю) и работа будет максимальная:
Amax = QE
Для одного моля вещества, вступающего в реакцию, Q = nF, где n - число электронов, принимаемых или отдаваемых веществом; F = 96500 Кл/моль, число Фарадея, это количество электричества, необходимое для выделения 1 моль вещества. С учетом этого можно записать:
DG = Amax = nF x
В стандартных условиях:
DG = - nF x .
Взаимосвязь между напряжением гальванического элемента и значением DG дает возможность непосредственно определить величину DG.
Для медно - цинкового элемента
Amax = -DG298 o + 2*96500*1,1 = 212300 Дж = 212,3 кДж
Это значение DG совпадает с измеренной стандартной энтальпией для этой реакции, равной -212,3 кДж. Большое влияние на величину электродного потенциала оказывает концентрация катионов, одноименных с металлом электрода. Электродный потенциал с учетом этого влияния вычисляется по формуле Нернста:
j = jo +( RT/nF) ln C
где j0 - нормальный потенциал металла, В;
n - его валентность (ряд иона металла);
C - концентрация катионов этого же металла в моль /л;
Для газообразных веществ под знаком логарифма вместо Ci входят парциальные давления соответствующих веществ. Учитывая, что обычно гальванические элементы работают при стандартных условиях, уравнение Нернста можно записать:
j = j o + (0,059/n )lg C
Электродвижущая сила (ЭДС) — физическая величина, характеризующая работу сторонних (непотенциальных) сил в источниках постоянного или переменного тока. В замкнутом проводящем контуре ЭДС равна работе этих сил по перемещению единичного положительного заряда вдоль контура.
ЭДС можно выразить через напряжённость электрического поля сторонних сил (Eex). В замкнутом контуре (L) тогда ЭДС будет равна:
![]() ,
,
где dl — элемент длины контура.
ЭДС, так же как и напряжение, измеряется в вольтах.
Гальванические элементы как источники электрической энергии обладают существенными преимуществами: они могут быть различных размеров и форм, не имеют макроскопически подвижных, подверженных износу частей, относительно легки и автономны, мало чувствительны к вибрации и колебаниям температуры, работают бесшумно, хорошо регулируются. Их КПД довольно высок (до 90%), так как превращение химической энергии в электрическую совершается в них без промежуточной тепловой стадии, а электродные процессы в некоторых случаях близки к обратимым.
Существенным недостатком гальванических элементов является саморазряд - расходование ими электрохимически активных веществ при отсутствии внешнего тока. Причиной этого может быть- например, растворение металла электродов вследствие образования tax называемых локальных элементов, или протекание процесса, генерирующего ток, "непосредственным химическим" путем, или же недостаточная изолирующая способность диэлектрических деталей элемента. Саморазряд уменьшает срок службы элемента, последний со временем становится непригодным, даже если он вообще не использовался для получения энергии.
Похожие работы
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
... подкрепляет своим одобрением неправильный или не вполне точный ответ ученика. 1.2 Совершенствование школьного химического эксперимента при проблемном обучении 1.2.1 Принципы разработки методической системы и содержания опытов по химии в системе проблемного обучения Характерной особенностью развивающего обучения является широкое использование проблемного подхода, который включает создание ...
... учебного времени - четверти, полугодия и т. п.). Заключительный контроль проводится в конце года или в конце всего курса обучения в виде выпускного экзамена. Внутри названных форм и видов контроля усвоения различают методы контроля. Их рассматривают по группам, соответствующим устной, письменной, экспериментальной и компьютерной формам проверки. В арсенале учителя много методов контроля ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
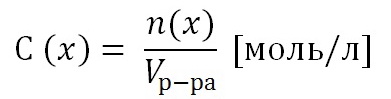
0 комментариев