Навигация
Результаты эксперимента и их обсуждение
3. Результаты эксперимента и их обсуждение
3.1 Разработка новых молекулярных структур на основе дикаина
Несмотря на достижения современной анестезии, продолжаются поиски менее опасных средств для наркоза, разработка различных вариантов многокомпонентного избирательного наркоза, позволяющего значительно снизить дозы используемых средств, уменьшить их токсичность и побочные отрицательные влияния [19]. В последнее время методы компьютерного моделирования все более входят в практику технологии создания новых синтетических лекарственных веществ [9]. Этот подход позволяет установить стехиометрические особенности молекулы лекарственного соединения, измерить расстояние между отдельными атомами, определить потенциал биоактивности, комплементарность взаимодействия с биорецепторным участком. Получаемые таким образом данные позволяют более целенаправленно проводить синтезы биоактивных молекул с заданными на молекулярном уровне параметрами, что значительно экономит время, материалы и силы при аналоговом поиске лекарственных веществ.
Дикаин применяется для поверхностной анестезии. Под влиянием местных анестетиков в окончании нерва и в самом нерве прекращается электрохимический процесс, осуществляющий передвижение ионов через мембрану и распространение нервных импульсов. Область окончания чувствительных нервов находится под регулирующим влиянием системы медиаторных рецепторов, синергентное взаимодействие, которых обеспечивает более эффективное развитие торможения. Известно, что в присутствии противогистаминных средств (димедрол), м-холиноблокаторов (атропин) и адреналина усиливается местноанестезирующий эффект [20].
Дикаин относится к классу сложных эфиров п-аминобензойной кислоты (β-диметиламиноэтиловый эфир п-бутиламинобеизойной кислоты гидрохлорид) [8].
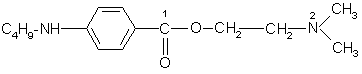
Анестезиофорной группой является диалкиламиноацетанилид. Расстояние между ![]() и
и ![]() атомами определяет двухточечный контакт молекулы дикаина с рецептором через диполь-дипольное и ионное взаимодействие. В структуру молекулы дикаина входит фрагмент биогенного вещества коламина (2-аминоэтанола), производные которого оказывают противогистаминный эффект. Дикаин активнее своих аналогов (анестезина и новокаина), но и токсичнее их в несколько раз. Его используют главным образом в глазной и оториноларингологической практике.
атомами определяет двухточечный контакт молекулы дикаина с рецептором через диполь-дипольное и ионное взаимодействие. В структуру молекулы дикаина входит фрагмент биогенного вещества коламина (2-аминоэтанола), производные которого оказывают противогистаминный эффект. Дикаин активнее своих аналогов (анестезина и новокаина), но и токсичнее их в несколько раз. Его используют главным образом в глазной и оториноларингологической практике.
Нами предложены варианты новых структур для компьютерного дизайна молекулы дикаина с целью снижения его токсичности с сохранением или даже усилением анестезирующих свойств.
Введение в бензольное кольцо «облагораживающей» карбоксильной группы и замена диметиламиногруппы на более фармакоактивную диэтиланиногруппу позволит снизить токсичность соединения, облегчить гидролиз сложноэфирной связи с высвобождением антигистаминного фрагмента - диэтиламиноэтанола.
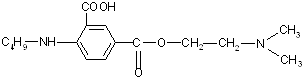
Алифатический радикал н-бутил в структуре дикаина усиливает фармакологический эффект. При замене его на адреналиновый фрагмент ожидается получить более яркое анестезирующее действие.
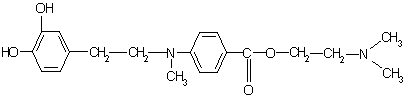
К настоящему времени известно, что биологические системы не делают различия между плоскими кольцами, поэтому при замене ароматической основы н-аминобензойной кислоты на никотиновую (или изоникотиновую) кислоту изменяется полярность молекулы, облегчается задача введения различных заместителей в ароматическое кольцо. К тому же, аминопроизводные никотиновой кислоты (кордиамин) являются стимуляторами центральной нервной системы.
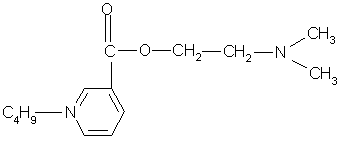
Один из наиболее эффективных анестетиков, промедол, содержит в структуре вместо ароматического пиридинового кольца пиперидиновое, что является предпосылкой для модификации молекулы дикаина.
3.2 Результаты исследований с помощью программы HyperChem
Таблица 1
| Длина связи или валентный угол | Данные ММ расчёта | Данные MNDO расчёта | Справочные величины |
| С1-С2 С2-С3 С3-С4 С4-N5 N5-C6 C6-C7 C7-C9 C9-C11 C10-C11 C8-C10 C6-C8 C11-C12 C12-O13 C12-O14 O14-C15 C15-C16 C16-N17 N17-C19 N17-C18 C1-C2-C3 С2-С3-С4 C3-C4-N5 N5-C6-C8 N5-C6-C7 C6-C7-C9 C7-C9-C11 C9-C11-C10 C11-C10-C8 C10-C8-C6 C8-C6-C7 C9-C11-C12 C10-C11-C12 C12-O14-C15 O14-C15-C16 C15-C16-N17 C16-N17-C18 C16-N17-C19 C18-N17-C19 | 1,53442 1,53705 1,53626 1,44712 1,35045 1,34373 1,34335 1,34525 1,3446 1,34261 1,34354 1,36294 1,21202 1,35065 1,40995 1.53635 1,45672 1,45174 1,45291 111,792 113,518 109,67 118,219 123,605 120,397 120,124 119,658 119,913 120,666 119,242 119,948 122,115 118,556 107,759 113,916 111,47 113,282 111,148 | 1,53158 1,54128 1,54862 1,46777 1,41076 1,41935 1,40351 1,41482 1,41571 1,40009 1,42528 1,49637 1,22988 1,36302 1,41167 1,56222 1,47112 1,46359 1,46386 114,547 113,518 111,073 118,219 123,605 120,589 121,461 117,898 121,164 120,879 117,974 119,948 122,115 124,819 107,759 109,436 116,806 117,015 116,056 | 1,534 1,536 1,539 1,456 1,411 1,393 1,355 1,381 1,392 1,356 1,352 1,383 1,218 1,386 1,382 1,559 1,493 1,432 1,451 113,125 113,529 110,053 118,953 123,983 120,159 120,956 118,241 120,971 120,264 118,325 119,948 122,233 121,179 107,563 110,563 115,963 115,912 116,023 |
Сравнивая полученные результаты, оба метода имеют небольшие отклонения по сравнению со стандартными данными.
Расположение молекулы немного изменяется в зависимости от применяемого метода.
Положительный знак электростатического потенциала отображается зелёным цветом. В области неподелённых пар на атомах азота, кислорода электрический потенциал отрицательный, что отображается красным цветом.
Изменение потенциальной энергии связи C16-N17.
Исследуемая связь между атомами C16-N17. Задаём начальные величины начальная длина связи 0,971; конечная длина связи 2,971; шаг 0,1. Проведя расчёты, изобразим график изменения потенциальной энергии связи C16-N17 от величины растяжения.
Изменение потенциальной энергии углового напряжения C3-C4-C5.
Исследуем угол между атомами C3-C4-C5. Задаём начальные величины начальный угол 80; конечный 140; шаг 10. Проведя расчёты, изобразим график изменения энергии углового напряжения при изменении величины угла.
Таблица 2
| Длина связи или валентный угол | Данные ММ расчёта | Данные MNDO расчёта | Справочные величины |
| C1-C2 C2-C3 C3-C4 C4-N5 N5-C6 C6-C7 C7-C9 C9-C10 C10-C11 C11-C8 C6-C8 C7-C12 C12-O13 C12-O14 C10-C15 C15-O16 C15-O17 O17-C18 C18-C19 C19-N20 N20-C23 C23-C24 N20-C21 C21-C22 C1-C2-C3 C2-C3-C4 C3-C4-N5 C4-N5-C6 N5-C6-C7 N5-C6-C8 C6-C7-C12 C7-C12-O13 C7-C12-O14 C6-C7-C9 C7-C9-C10 C9-C10-C11 C10-C11-C8 C6-C8-C11 C8-C6-C7 C11-C10-C15 C9-C10-C15 C10-C15-O16 C10-C15-O17 O16-C15-O17 C15-O17-C18 O17-C18-C19 C18-C19-N20 C19-N20-C21 C19-N20-C23 N20-C23-C24 N20-C21-C22 | 1,53446 1,53687 1,53769 1,46773 1,35455 1,34989 1,34842 1,3461 1,34288 1,34136 1,34515 1,36573 1,20944 1,33807 1,36377 1,21204 1,35143 1,41104 1,53791 1,46268 1,45983 1,53447 1,46076 1,53704 111,785 112,138 110,841 116,92 124,692 115,847 123,329 123,901 121,905 119,209 120,947 119,665 119,499 121,203 119,456 119,282 121,051 119,494 121,218 119,22 118,218 108,252 114,762 111,29 111,699 116,769 113,058 | 1,53154 1,54091 1,5495 1,47515 1,43364 1,423 1,41348 1,41233 1,41258 1,40248 1,41671 1,50204 1,22891 1,35818 1,50134 1,22774 1,35955 1,41312 1,5631 1,47233 1,47481 1,53447 1,47478 1,53801 111,785 113,622 110,841 119,144 118,391 122,522 121,784 126,174 144,416 119,516 121,22 118,829 120,542 120,848 118,99 121,044 120,117 125,793 113,418 120,418 125,334 107,378 110,057 116,349 116,243 112,593 112,593 | 1,532 1,539 1,544 1,483 1,423 1,312 1,342 1,401 1,362 1,341 1,395 1,502 1,211 1,348 1,551 1,221 1,355 1,413 1,531 1,452 1,453 1,534 1,460 1,538 111,785 112,953 110,841 117,526 117,318 117,286 122,463 123,901 144,411 119,291 121,231 118,973 119,513 121,203 119,361 120,964 121,051 120,169 119,432 120,111 119,213 107,314 112,953 113,561 114,246 111,548 112,987 |
Сравнивая полученные результаты, оба метода имеют небольшие отклонения.
Расположение молекулы немного изменяется в зависимости от применяемого метода.
Положительный знак электростатического потенциала отображается зелёным цветом. В области неподелённых пар на атомах азота, кислорода электрический потенциал отрицательный, что отображается красным цветом.
Изменение потенциальной энергии связи C6-С11.
Исследуемая связь между атомами C6-С11. Задаём начальные величины начальная длина связи 1,037; конечная длина связи 3,037; шаг 0,1. Проведя расчёты, изобразим график изменения потенциальной энергии связи C6-C11 от величины растяжения.
Изменение потенциальной энергии углового напряжения C6-C11-O14.
Исследуем угол между атомами C6-C11-O14. Задаём начальные величины начальный угол 90; конечный 150; шаг 10. Проведя расчёты, изобразим график изменения энергии углового напряжения при изменении величины угла.
Объектом является химическое соединение.
Таблица 3
| Длина связи или валентный угол | Данные ММ расчёта | Данные MNDO расчёта | Справочные величины |
| O1-C2 C2-C3 C3-C4 C4-C5 C5-C7 C6-C7 C2-C6 C3-O8 C5-C9 C9-C10 C10-N11 N11-C12 N11-C13 C13-C14 C14-C15 C15-C16 C16-C18 C17-C18 C13-C17 C16-C19 C19-C20 C19-O21 O21-C22 C22-C23 C23-N24 N24-C25 N24-C26 O1-C2-C6 O2-C2-C3 C2-C3-C4 C3-C4-C5 C4-C5-C7 C5-C7-C6 C2-C6-C7 C3-C2-C6 O8-C3-C2 O8-C3-C4 C4-C5-C9 C7-C5-C9 C5-C9-C10 C9-C10-N11 C10-N11-C12 C13-N11-C12 C14-C13-N11 C17-C13-N11 C13-C14-C15 C14-C15-C19 C15-C16-C18 C16-C18-C17 C13-C17-C18 C17-C13-C14 C19-C16-C18 C19-C16-C15 O20-C19-C16 O21-C19-C16 O20-C19-O21 C19-O21-C22 O21-C22-C23 C22-C23-N24 C23-N24-C25 C23-N24-C26 C25-N24-C26 | 1,36051 1,34612 1,34441 1,3441 1,34399 1,34099 1,34297 1,36079 1,51602 1,54091 1,46417 1,45765 1,35257 1,3425 1,34235 1,34536 1,34524 1,34278 1,34206 1,36228 1,21202 1,35004 1,4099 1,53786 1,45675 1,45323 1,45163 120,802 120,483 119,222 122,579 117,432 120,669 121,368 118,714 120,184 120,594 121,181 121,385 115,402 114,762 123,704 116,621 120,198 119,72 120,071 119,877 120,004 119,927 120,013 120,082 119,383 120,612 119,581 120,826 119,469 119,174 110,679 113,688 111,433 113,311 111,143 | 1,35748 1,43712 1,4148 1,41582 1,41064 1,4048 1,41425 1,35924 1,51423 1,55179 1,47428 1,47004 1,43737 1,41646 1,40524 1,41186 1,41199 1,4048 1,41809 1,501 1,22707 1,36061 1,41166 1,5624 1,47048 1,46449 1,46417 123,264 118,062 119,488 121,583 118,032 121,572 120,637 118,674 117,63 122,882 121 120,916 117,262 113,931 116,04 114,642 123,731 117,39 120,376 120,696 118,949 120,676 120,373 118,878 120,928 120,123 126,438 112,643 120,919 125,616 107,249 109,754 116,591 116,835 115,996 | 1,359 1,381 1,368 1,388 1,347 1,358 1,413 1,362 1,514 1,551 1,469 1,462 1,395 1,561 1,395 1,354 1,456 1,400 1,346 1,447 1,210 1,369 1,469 1,537 1,475 1,462 1,495 122,645 119,472 119,265 121,583 117,463 120,873 121,145 118,714 118,139 121,246 121,012 121,213 114,786 113,746 122,612 115,621 120,198 118,365 120,376 120,519 119,789 120,581 120,373 120,566 120,491 120,573 122,469 117,721 120,651 123,125 108,452 110,956 117,854 114,651 113,786 |
Сравнивая полученные результаты, оба метода имеют небольшие отклонения.
Расположение молекулы немного изменяется в зависимости от применяемого метода.
Положительный знак электростатического потенциала отображается зелёным цветом. В области неподелённых пар на атомах азота, кислорода электрический потенциал отрицательный, что отображается красным цветом.
Изменение потенциальной энергии связи N11-С13.
Исследуемая связь между атомами N11-С13. Задаём начальные величины начальная длина связи 2,36; конечная длина связи 5,666; шаг 0,1. Проведя расчёты, изобразим график изменения потенциальной энергии связи N11-С13 от величины растяжения.
Изменение потенциальной энергии углового напряжения C19-О21-С22.
Исследуем угол между атомами C19-О21-С22. Задаём начальные величины начальный угол 70; конечный 130; шаг 10. Проведя расчёты, изобразим график изменения энергии углового напряжения при изменении величины угла.
Оптимизация геометрии и расчёт параметров молекулы методом молекулярной механики (ММ+ и MNDO метод).
Таблица 4
| Длина связи или валентный угол | Данные ММ расчёта | Данные MNDO расчёта | Справочные величины |
| С1-С2 С2-С3 С3-С4 С4-N5 N5-C6 C6-C7 C7-C8 C41-C8 C9-C41 C5-C9 C7-C10 C10-O11 C10-O12 O12-C13 C13-C14 C14-N15 N15-C16 N15-C17 C1-C1-C3 C2-C3-C4 C3-C4-N5 C4-N5-C6 C4-N5-C9 N5-C6-C7 C6-C7-C8 C7-C8-C41 C8-C41-C9 C41-C9-N5 C9-N5-C6 C6-C7-C10 C8-C7-C10 C7-C10-C11 C7-C10-O12 C10-O12-O13 O12-C13-C14 C13-C14-N15 C14-N15-C16 C14-N15-C17 C16-N15-C17 | 1,53455 1,53762 1,5369 1,468 1,45685 1,5104 1,34294 1,34042 1,33896 1,35217 1,36168 1,21147 1,34976 1,41025 1,53651 1,45706 1,45297 1,4518 111,892 111,685 111,781 122,06 119,167 114,299 120,314 120,526 122,338 123,23 118,447 121,465 118,218 117,423 122,29 118,494 107,986 113,797 111,518 113,334 111,185 | 1,53153 1,54118 1,55042 1,47213 1,4767 1,51705 1,36463 1,44632 1,36782 1,39475 1,49687 1,22888 1,36285 1,41128 1,56218 1,47138 1,46379 1,46434 114,534 113,462 113,494 118,349 119,969 113,836 121,488 120,452 120,512 121,692 121,63 116,046 122,464 126,415 113,517 125,248 107,536 109,6 116,738 116,78 115,933 | 1,532 1,538 1,542 1,468 1,463 1,517 1,352 1,395 1,338 1,394 1,419 1,226 1,339 1,411 1,541 1,468 1,462 1,468 113,589 113,452 113,642 119,486 119,165 113,863 121,488 120,526 121,514 122,945 119,449 120,064 118,218 126,435 122,651 125,984 107,892 110,674 115,465 115,639 113,746 |
Сравнивая полученные результаты, оба метода имеют небольшие отклонения.
Расположение молекулы немного изменяется в зависимости от применяемого метода.
Положительный знак электростатического потенциала отображается зелёным цветом. В области неподелённых пар на атомах азота, кислорода электрический потенциал отрицательный, что отображается красным цветом.
Изменение потенциальной энергии связи С4–N5.
Исследуемая связь между атомами С4–N5. Задаём начальные величины начальная длина связи 0,972; конечная длина связи 2,972; шаг 0,1. Проведя расчёты, изобразим график изменения потенциальной энергии связи С4–N5 от величины растяжения.
Изменение потенциальной энергии углового напряжения C2-C3-С4.
Исследуем угол между атомами C2-C3-С4. Задаём начальные величины начальный угол 50; конечный 140; шаг 10. Проведя расчёты, изобразим график изменения энергии углового напряжения при изменении величины угла.
Оптимизация геометрии и расчёт параметров молекулы методом молекулярной механики (ММ+ и MNDO метод).
- Проведение оптимизации молекулы.
ММ+ метод.
Таблица 5
| Длина связи или валентный угол | Данные ММ расчёта | Данные MNDO расчёта | Справочные величины |
| С1-С2 С2-С3 С3-С4 С4-N5 N5-C6 C6-C8 C8-C10 C9-C10 C7-C9 N5-C7 C10-C11 C11-O12 C11-O13 O13-C14 C14-C15 C15-N16 N16-C17 N16-C18 C1-C2-C3 C2-C3-C4 C3-C4-N5 C4-N5-C7 C4-N5-C6 N5-C7-C9 C7-C9-C10 C9-C10-C8 C6-C8-C10 C8-C6-N5 C6-N5-C7 C10-C11-O12 C9-C10-C11 C8-C10-C11 C10-C11-O13 O12-C11-O13 C11-O13-C14 C13-C14-C15 C14-C15-N16 C15-N16-C17 C15-N16-C18 | 1,53461 1,53838 1,53856 1,45536 1,45232 1,53586 1,53611 1,53558 1,536 1,4525 1,52029 1,20871 1,34376 1,40919 1,53584 1,45663 1,45283 1,45193 111,827 111,685 116,445 113,912 113,888 111,468 110,753 108,473 112,918 111,794 116,304 127,3 110,877 112,884 112,782 119,917 125,512 107,339 109,614 116,591 116,809 | 1,53147 1,54129 1,55152 1,47019 1,46727 1,54676 1,54834 1,54919 1,5454 1,46687 1,54228 1,22757 1,36181 1,41133 1,56262 1,47096 1,46422 1,4643 114,597 113,519 116,865 117,555 117,81 111,826 113,034 111,009 112,918 111,794 116,304 127,3 110,877 112,884 112,782 119,917 125,512 107,339 109,614 116,591 116,809 | 1,533 1,539 1,542 1,467 1,467 1,539 1,539 1,542 1,542 1,468 1,534 1,213 1,352 1,412 1,556 1,472 1,468 1,464 113,654 113,512 116,865 116,526 116,956 111,429 111,485 111,006 112,918 111,783 116,304 127,3 110,563 112,853 112,782 119,456 125,654 107,339 110,369 115,654 116,809 |
Сравнивая полученные результаты, оба метода имеют небольшие отклонения.
Расположение молекулы немного изменяется в зависимости от применяемого метода.
Положительный знак электростатического потенциала отображается зелёным цветом. В области неподелённых пар на атомах азота, кислорода электрический потенциал отрицательный, что отображается красным цветом.
Изменение потенциальной энергии связи С4–N5.
Исследуемая связь между атомами С4–N5. Задаём начальные величины начальная длина связи 0,97; конечная длина связи 2,97; шаг 0,1. Проведя расчёты, изобразим график изменения потенциальной энергии связи С4–N5 от величины растяжения.
Изменение потенциальной энергии углового напряжения C2-C3-С4.
Исследуем угол между атомами C2-C3-С4. Задаём начальные величины начальный угол 50; конечный 140; шаг 10. Проведя расчёты, изобразим график изменения энергии углового напряжения при изменении величины угла.
3.3 Исследование биологической активности с помощью программы PASS
В работе выполнено исследование биологической активности всех молекулярных структур с помощью программы PASS согласно методике п.2.2.
Дикаин

Если величина Pa близка к единице, то вещество может оказаться близким аналогом известных препаратов.
Базовые структуры лекарств, обладающие существенной новизной, целесообразно отбирать из массива доступных веществ соединения с Pa<0.7. Риск получения отрицательного результата в эксперименте тем больше, чем меньше величина Pa, однако и новизна такой структуры (при подтверждении прогноза в эксперименте) будет более высокой [12]. Pa Pi:
0.603 0.023 спазмолитик,
0.511 0.048 сосудорасширяющее средство,
0.405 0.015 антагонист кальциевых каналов,
0.350 0.107 антигипертензивный,
0.323 0.166 токсичный,
0.114 0.098 агонист β – адренорецепторов,
0.219 0.214 тератоген,
0.092 0.091 антагонист β – адренорецепторов.
1. Структура 1 (карбоксиструктура).
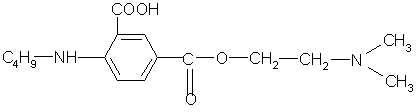 Pa Pi:
Pa Pi:
0.591 0.025 спазмолитик,
0.367 0.095 сосудорасширяющее средство,
0.264 0.051 антагонист кальциевых каналов,
0.331 0.160 токсичный,
0.301 0.142 антигипертензивный,
0.211 0.144 диуретик,
0.233 0.195 тератоген,
0.113 0.101 агонист β – адренорецепторов,
0.092 0.090 антагонист β – адренорецепторов.
2. Структура 2 (адреноструктура).
 Pa Pi:
Pa Pi:
0.620 0.021 спазмолитик,
0.472 0.059 сосудорасширяющее средство,
0.362 0.020 антагонист кальциевых каналов,
0.218 0.041 агонист дофамина,
0.128 0.020 агонист Д2 дофамина,
0.291 0.188 токсичный,
0.144 0.041 агонист β1 – адренорецепторов,
0.139 0.043 агонист β – адренорецепторов,
0.243 0.182 тератоген,
0.237 0.211 антигипертензивный,
0.133 0.119 агонист α – адренорецепторов.
3. Структура 3 (никотиноструктура).
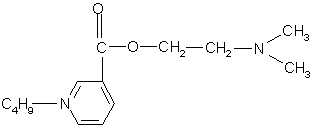
Pa Pi:
0.683 0.017 сосудорасширяющее средство,
0.548 0.031 спазмолитик,
0.326 0.026 антагонист кальциевых каналов,
0.364 0.098 антигипертензивный,
0.171 0.066 агонист дофамина.
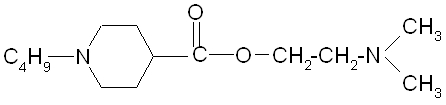
4. Структура 4 (пиперидиноструктура).
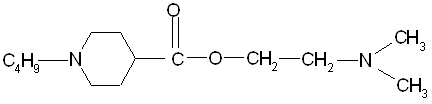
Pa Pi:
0.680 0.015 спазмолитик,
0.537 0.042 сосудорасширяющее средство,
0.411 0.014 антагонист кальциевых каналов,
0.402 0.078 антигипертензивный,
0.233 0.051 антагонист α1 – адренорецепторов,
0.253 0.075 агонист α – адренорецепторов
0.216 0.081 антагонист адреналина.
После исследования биологической активности ряда веществ можно сделать вывод, что все структуры обладают новизной. Есть большая вероятность, что они будут обладать спазмолитической, сосудорасширяющей активностью и являются антагонистами кальциевых каналов.
Суммарно характеристики биологической активности всех молекулярных структур предложены в таблице 6.
Таблица 6
| Характерис-тика фармако-логической активности | Основ-ная струк-тура | Модифицированные структуры | |||
| Дикаин | Структура 1 Карбокси-структура | Структура 2 Адрено-структура | Структура 3 Никотино-структура | Структура 4 Пиперидиноструктура | |
| 1. Спазмолитик | 0,603 0,023 | 0,591 0,025 | 0,620 0,021 | 0,683 0,017 | 0,680 0,015 |
| 2. Сосудорасши-ряющее средство | 0,511 0,048 | 0,367 0,095 | 0,472 0,059 | 0,548 0,031 | 0,537 0,042 |
| 3. Антагонист кальциевых каналов | 0,405 0,015 | 0,264 0,051 | 0,362 0,020 | 0,326 0,026 | 0,411 0,014 |
| 4. Антигипер-тензивный | 0,350 0,107 | 0,301 0,142 | 0,237 0,211 | 0,364 0,098 | 0,402 0,078 |
| 5. Агонист β-адренорецепторов | 0,114 0,098 | 0,113 0,101 | 0,139 0,043 | ||
| 6. Токсичный | 0,323 0,166 | 0,331 0,160 | 0,291 0,188 | ||
| 7. Тератоген | 0,219 0,214 | 0,233 0,195 | 0,243 0,182 | ||
| 8. Антагонист β-адрено-рецепторов | 0,092 0,091 | 0,092 0,09 | |||
| 9. Диуретик | 0,211 0,144 | ||||
| 10. агонист | 0,144 0,041 | ||||
| 11. Агонист α-адрено-рецепторов | 0,133 0,119 | 0,253 0,075 | |||
| 12. Антагонист | 0,233 0,051 | ||||
Краткое описание позиций проявленной фармакологической активности.
Похожие работы
... на фармакологический эффект, усложняет процесс изыскания новых Л В. Тем не менее современные методы исследования позволили определить предпосылки решения этой важной проблемы. 7 Предпосылки создания новых лекарственных веществ Изыскание новых ЛВ осуществляют различными путями. Ведущим направлением являются исследования в области модификации структуры известных природных БАВ. Одним из ...
... процесс разделения нестабильных веществ можно проводить в холодильной камере. Выделенное соединение подвергают структурному химическому исследованию, а затем изучают его фармакологическое действие. Получение лекарственных веществ методом культуры тканей высших растений В нашей стране заготавливаются десятки тысяч тонн ЛРС. Однако потребность в БАВ, содержащихся в растениях, с каждым годом ...
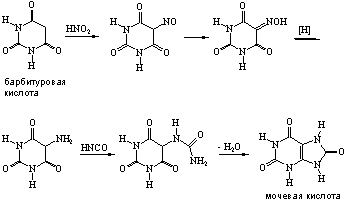
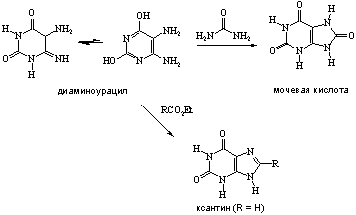
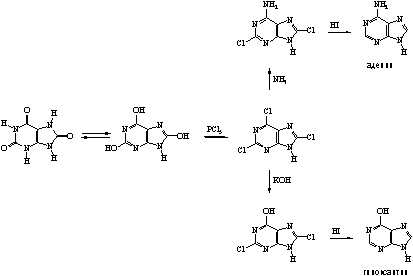
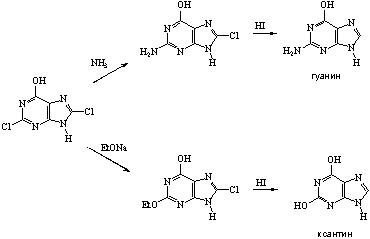
... 6. При взаимодействии продуктов замещения с иодистоводородной кислотой происходит гидродехлорирование атомов хлора, сохранившихся в молекуле после реакции с нуклеофилом, что приводит к образованию двух важных производных пурина - 6-оксипурина (гипоксантина) и 6-аминопурина (аденина). После замещения атома хлора в положении 6 можно провести замещение атома хлора в положении 2. Различие в ...
... с высокой пропускной способностью (HTS-метод). Сегодня HTS-метод (High Throughput Screening) повсеместно используется в фармацевтической индустрии для открытия новых лекарственных средств. С помощью высокоскоростной компьютеризованной технологии сотни тысяч веществ проверяются на активность относительно исследуемой молекулы, предназначенной для взаимодействия[8]. 2. Применение компьютерного ...

0 комментариев