Навигация
Исследование активности ангиотензинпревращающего фермента в сыворотке крови онкологических больных в раннем послеоперационном периоде
3.2 Исследование активности ангиотензинпревращающего фермента в сыворотке крови онкологических больных в раннем послеоперационном периоде
Результаты исследования показали достоверное увеличение активности АПФ в сыворотке крови онкологических больных урологического отделения по сравнению с пациентами абдоминального и торакального отделения (рис.2).
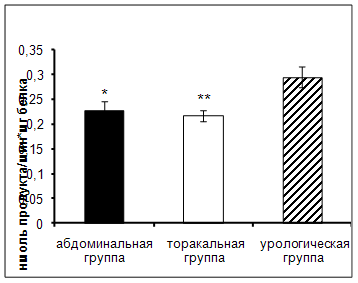
Рис. 2. Активность АПФ у онкологических больных в ранний послеоперационный период (нмоль продукта, образовавшегося за 1 мин инкубации на 1 мг белка, M±m, n=12¸18; достоверность отличий * – р < 0,05, ** – р < 0,01 относительно урологической группы).
АПФ – мембранно-связанный фермент, локализованный преимущественно в тканях почек. Этот фермент является компонентом ренин – ангиотензиновой системы [4, 48]. При повреждении почек, в том числе и хирургического вмешательства, происходит высвобождение АПФ в кровоток, что приводит к увеличению активности фермента.
При проведении корреляционного анализа (табл. 4) была обнаружена отрицательная корреляционная взаимосвязь между активностью АПФ и уровнем РФМК у пациентов абдоминального отделения. У больных, страдающих онкологическим заболеванием, антитромбогенная активность стенок сосудов в процессе роста опухоли снижается, а в раннем послеоперационном периоде обнаруживается повышенная склонность к внутрисосудистому свертыванию крови и тромбообразованию [8, 11, 19, 34, 35]. Известно так же, что в эндотелии содержится большое количество активатора плазминогена. Эндотелиальная дисфункция способствует уменьшению этого процесса, что вызывает сдвиг в системе антикоагуляция-коагуляция с преобладанием последней [73]. Участие АПФ в регуляции сосудистого тонуса реализуется через синтез ангиотензина-II, оказывающего мощное вазоконстрикторное действие. Другой механизм, более сопряженный с собственно эндотелиальной дисфункцией, связан со способностью АПФ ускорять деградацию брадикинина. Ангиотензин II является вазопрессором, стимулятором образования свободных радикалов, в частности, супероксидных анионов, которые инактивируют NO, промотируют образование пероксинитрита и снижают эффективность NO-опосредуемой сосудистой дилатации. Т.о., ангиотензин II, способствует развитию эндотелиальной дисфункции, в результате чего усиливается выработка вазоконстрикторов и прокоагулянтов [48]. В результате активируется система свертывания, компонентом которой является РФМК. В то время как брадикинин стимулирует синтез NO в эндотелии, участвуя в дилатации сосудов и усиливая скорость местного кровотока. Вероятно,
Таблица 4 Корреляционные взаимосвязи параметров гемостаза и ангиотензинпревращающего фермента
| Параметры гемостаза | Активность АПФ | ||
| Абдоминальная группа | Торакальная группа | Урологическая группа | |
| КПN | -0,7 | 0,23 | 0,19 |
| АПФ | 1,00 | 1,00 | 1,00 |
| Тромбоциты | -0,72 | 0,55 | -0,45 |
| Время свертывания по Ли-Уайту | -0,92 | -0,20 | -0,31 |
| АПТВ | -0,54 | 0,24 | 0,78 |
| Протромбин | 0,41 | 0,71* | 0,48 |
| Тромбиновое время | 0,89 | 0,00 | 0,77 |
| Растворимый фибрин-мономерный комплекс | -0,99** | -0,39 | -0,73 |
| Фибриноген | 0,87 | 0,22 | 0,01 |
| Хагеман-зависимый фибринолиз | 0,81 | -0,10 | 0,18 |
Достоверность корреляционных взаимосвязей: *– р < 0,05, ** – р < 0,01. Снижение активности АПФ является компенсаторным механизмом в условиях имеющейся гиперкоагуляции.
Выявлена положительная корреляционная взаимосвязь между активностью АПФ и уровнем ПТИ у больных торакального отделения.
Исследования показали, что у больных злокачественными новообразования легких имеет место активация система гемостаза, осуществляемая преимущественно по внешнему механизму процесса свертывания крови, которая оценивается протромбиновым тестом [44]. Внешний путь начинается с повреждения сосудов и тканей, в результате чего в кровь высвобождается тканевый тромбопластин, которым богата легочная ткань. Этот фактор активирует фактор VII в присутствии ионов Са2+. Комплекс, состоящий из фактора III, фактора VIIа, ионов Са2+ на поверхности тромбоцитов приводит к активации фактора Х [44]. Известно, что в кровь АПФ попадает из легких. При оперативных вмешательствах, вероятно, инкреция АПФ усиливается, что в свою очередь приводит к генерализованному образованию ангиотензина II, участвующего в агрегации тромбоцитов, на поверхности которых идет процесс внешнего пути свертывания крови. Кроме того, в результате хирургического вмешательства происходит не только высвобождение факторов свертывания крови, но и повреждение эндотелия сосудов, что в свою очередь приводит к изменению активности АПФ, так как он участвует в синтезе коллагена и может таким образом усиливать фиброз [22, 68], активируя тем самым свертывающую систему, компонентом которой является протромбин.
Выводы
1. Обнаружено увеличение активности карбоксипептидазы N у торакальной и абдоминальной групп по сравнению с урологической группой онкологических больных в раннем послеоперационном периоде.
2. Обнаружено увеличение активности ангиотензинпревращающего фермента у урологической группы пациентов по сравнению с абдоминальной и торакальной группами онкологических больных в раннем послеоперационном периоде.
3. Выявлены корреляционные взаимосвязи между активностью карбоксипептидазы N и ангиотензинпревращающего фермента и показателями гемостаза в раннем послеоперационном периоде.
4. Изучаемые ферменты принимают участие в процессах гемостаза у онкологических больных в раннем послеоперационном периоде.
Список литературы
1. Азарян А.В. Пептидгидролазы нервной системы и их биологические функции // Ереван: Анастан, 1989.
2. Акоев И. Г., Биофизика познает рак. — М.: Наука, 1988. —160 с, 17 ил. — (Серия «От молекулы до организма»).
3. Албертс Б., Брей Д., Льюис Дж., Рэфф М., Роберте К., Уотсон Дж. Молекулярная биология клетки: В 3-х т. 2-е изд., перераб. и доп. Т. 3. Пер. с англ. – М.: Мир, 1994. – 504 с.
4. Альтшулер Б.Ю., Ройтман А.П., Долгов В.В. Методические аспекты определения ангиотензинпревращающего фермента // Клиническая лабораторная диагностика. – 2000. – №12. – С. 10– 14.
5. Антонова Л.В., Годенова Н.В., Земнюкова Н.А., Дудкина Н.Е. Опыт использования ортофенантролинового теста в диагностике синдрома ДВС в крови у пациенток с онкологическими заболеваниями репродуктивной сферы. // Медицина в Кузбассе. – 2004. – №11. – С. 26– 27.
6. Бакшеев Н.С., Ильяшенко Н.А.,Миляновский А.И. в кн. Злокачественные новообразования женских половых органов. – М., 1987. –С. 85– 187.
7. Баркаган З.С. Введение в клиническую гемостазиологию. – М.: Ньюдиамед, 1998. – 290 с.
8. Баркаган З. С. Патогенез и терапия нарушений гемостаза у онкологических больных // Терапевтический архив. – 1997. – №7. – С. 65– 67.
9. Баркаган З. С. Антитромботическая профилактика и терапия в онкологии. // Materia Medica. – 1997. – № 1 (13). – С. 5-14.
10. Баркаган З. С., Момот А.П. Диагностика и контролируемая терапия нарушений гемостаза. – М.: Ньюдиамед, 2001. – 298 с.
11. Баркаган Л.З. Нарушение гемостаза у детей. – М., 1993.
12. Биохимия: Учеб. Для вузов / В.П. Комов., В.Н. Шведова. – М.: Дрофа, 2004. – 640с.
13. Веремеенко К.Н., Голобородько О.П. Претромботическое состояние. Тромбоз и его профилактика. // Вопр. мед. химии . – 1986. – № 32. – С. 17– 25.
14. Вернигора А.Н., Генгин М.Т. Протеолитические ферменты: субклеточная локализация, свойства и участие в обмене нейропептидов // Биохимия. – 1996,т.6, №5. – С. 771– 785.
15. Гешелин С.А., Вовчук С.В., Близнюк Б.Ф.Нарушения гемостаза и их профилактика в онкологии. // Вопр. Онкологии. – 1986. – № 30. – С. 9– 18.
16. Гланц С. Медико-биологическая статистика: Пер. с англ. – М, Практика, 1998. – 459с.
17. Городецкий В.М. Неоплазмы и свертывание крови // Гематол. и трансфузиол. – 1994. – № 3. – С.25– 28.
18. Гринштейн Дж., Виниц M., Химия аминокислот и пептидов, пер. с англ., т. 12, M., 1967. – 350 с.
19. Давыдов М. И. Активация гемокоагуляции у больных в критических состояниях // Современная онкология. – 2000. – Т. 2, № 4. – С. 54– 58.
20. Долгов В.В., Сварин П.В. Лабоараторная диагностика нарушений гемостаза. – М. Изд. Триада, 2005. – 270 с.
21. Дэвени Т., Гергей Я. Аминокислоты, пептиды и белки, пер. с англ.- M.: 1976. – 380 с.
22. Елисеева Ю.Е. Ангиотензинпревращающий фермент, его физиологическая роль. // Вопросы медицинской химии. – 2001. – № 1. – С. 53– 60.
23. Ешкайт X. Аминокислоты, пептиды, белки, пер. с нем. – M.: 1985. – 460 с.
24. Золотокрылина Е.С. // Теоретические и клинические проблемы современной реаниматологии: Материалы международного симпозиума, посвящ. 90-летию со дня рожд. акад. В. А.Неговского. – М., 1999. – С. 32– 33.
25. Иванов Е.П. Диагностика нарушений гемостаза. Минск, 1983. – 278 с.
26. Калишевская Т. М., Коломина С. М., Кудряшов Б.А. Свертывающая и противосвертывающая системы крови и их значение при развитии злокачественных новообразований. – М., 1992. – 315 с.
27. Киричук В.Ф., Алипов В. В. Возможности диагностики активации системы гемостаза у больных в критических состояниях по уровню фибринопептида А и D-димера. // Кремлевская медицина. Клинический вестник. – 2005. – № 2. – С. 73– 76.
28. Кудряшов Б.А. Биологические проблемы регуляции жидкого состояния крови и ее свертывания. – М., 1975.
29. Лакин Г.Ф. Биометрия. – М.: Высш. шк., 1990. – 352с
30. Ленинджер А., Основы биохимии, пер. с англ., т. 1 3, M., 1985.
31. Локшина Л.А. Значение внутрисосудистого свертывания крови в формировании полиорганной недостаточности у хирургических больных в критических состояниях. // Новости анестезиологии и реаниматологии. – 2006. – № 1. – С. 15– 21.
32. Маджуга А. В., Сомонова О.В., Елизарова А. Л., Свиридова С.П., Мазурина, О.Г., Кашия Ш.Р. Нарушения системы гемостаза у онкологических больных с массивной интраоперационной кровопотерей // Анестезиология и реаниматология. – 2001. – № 5. – С. 50– 52.
33. Макацария А. Д., Бицадзе В. О., Баймурадова С. М., Акиньшина С. М.. Тромбофилия и здоровье женщины. // Сибирский медицинский журнал. – 2006. – №5(21). – С. 6– 8.
34. Мальков О.А. Гемостатические нарушения при колоректальном раке (вопросы патогенеза, диагностики, профилактики и лечения): Автореф. дис. …. канд. мед. наук. – Омск, 2000.
35. Мальков О.А., Долгих В.Т., Лукач В.Н. Комплексная профилактика тромботических осложнений у больных колоректальным раком на этапах хирургического лечения // Анастезиология и реаниматология . – 2001. – № 5. – С. 52 – 54.
36. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека: В 2-х томах. Т.2. Пер. с англ.: – М.: Мир, 1993. – 384с.
37. Ноздрачев Ю. И. Турбидиметрический анализ полимеризации фибрина в плазме крови. // Вестн. интенсив. тер. – 1995. – № 1. – С. 17– 22.
38. Оболенская Н.Е. Некоторые особенности образования нейропептидов // Успехи совр. биол. – 1989. – Т. 108, № 3(5). – С. 337– 341.
39. Патологическая физиология и биохимия: Учебное пособие для вузов / - М.: Издательство «экзамен», 205. – 480с.
40. Рокитский П.Ф. Биологическая статистика. – Минск, Высшая. Школа, 1963.
41. Серебров А.И. в кн. Рак матки, Медгиз, 1957. – 210– 233 с.
42. Система гемостаза [Электронный ресурс]. – Режим доступа: http//www.cmd-online.ru/help/articles/detail.php?ID=111739
43. Синдром Диссименированного внутрисосудистого свертывания [Электронный ресурс]. – Режим доступа: http://studentport.su/referast/ptint.php.
44. Скипетров В.П. и др. коагуляционно - литическая система тканей и тромбогеморрагический синдром в хирургии. – Саранск: тип. «Крас. Окт.», 1999. – 232 с.
45. Фермилен Ж. и Ферстраге М. Гемостаз, пер. с франц., М., 1984.
46. Филлипович Ю.Б. Основы биохимии: Учеб. для хим. и биол. спец. пед. ун-тов и ин-тов. – 4-е изд., перераб. и доп. – М.: изд-во «Агар», 1999. – 512с.
47. Шиффман Ф.Д. Патофизиология крови: Пер. с англ. – М., СПб., 2000. – С. 191-253.
48. Яровая Г. А. Калликреин-кининовая система: новые факты и концепции (обзор) // Вопросы медицинской химии. – 2001, том 47. – № 1. – с. 20-42.
49. Bokish V.A., Muller-Eberhard H.J. Anaphylotoxin inactivator in human plasma: Its isolation and characterisation as a carboxypeptidase // J. Clin. Invest. – 1970. – № 49. – P. 2427– 2436.
50. Bui Т.Н., Wramsby H. Micromanipulative assisted fertilization till clinical research. Hum Reprod. – 1996. – №11(5). – Р. 921– 924.
51. Chretien M., Seidah N.G. Precursor polyproteins in endocrine and neuroendocrine systems // Int. J. Peptide Protein Res. – 1984. – № 23. – P. 335– 341.
52. Ciavarella D., Reed R. L. et. al. // Br. J. Haematol. – 1987. – Vol. 67. – № 3. – Р. 365– 368.
53. Erdos E., Schulz W., Gafford J., Defendini R. Neutral metal endopeptidase in human male genital tract:comparison to angiotensin-1 converting enzyme. // Lab. Invest. – 1985. – V.52. – Р .4374– 47.
54. Erdos E.G. Handbook of Experimental Pharmacology. // Biochem. Pharmacol. – 1979. – № 25. – Р. 438-487.
55. Erdos E.G., Sloane E.M., Wohler I.M. Carboxypeptidase in blood and other fluids // Biochem. Pharmacol. – 1964. – №13. – P. 893– 905.
56. Fricker L.D., Plummer T.H.Jr., Snyder S.H. Enkephalin convertase: potent, selective and irreversible inhibitors // Biochem. Biophys. Res. Commun. – 1983. – 11, N 3. – P. 994– 1000.
57. Hendriks D., Sande M., Scharpe S. Colorimetric assay for carboxypeptidase N in serum // Clin. Chim. Acta. – 1986 . – 157, N 1. – P. 103– 108.
58. Hendriks D., Soons J., Scharpe S., Wevers R., van Sande M., Holmquist B. Identification of the carboxypeptidase responsible for the post-synthetic modification of creatine kinase in human serum // Clin. Chim. Acta. – 1988. – 172, N 2– 3. – P. 253– 260.
59. Hurst P.L., Lovell-Smith C.J. Optimized assay for serum angiotensin-converting enzyme activity // Clin. Chem.- 1981. – 27. – P. 2048– 2052.
60. Ito Y., Misutani S., Kurauchi O., Kasugai M., Narita O., Tomoda Y. Purification and properties of microsomal carboxypeptidase N (kininase I) in human placenta // Enzyme. – 1989. – №42. – P. 8– 14.
61. Khanna A.S., Waisman D.M. Metabolism and intracellular processing of protein hormones // Hormon. Act. – 1988. – № 1. – P. 117– 132.
62. Lee P.V., Takahashi T.N. An improved colorimetric determination of amino acid with the use of ninhydrin // Analyt. Biochem. – 1966. – 14, № 1. – P. 71– 77.
63. Levin Y., Skidgel R., Erdos E. Isolation and characterization of the subunits of human plasma carboxypeptidase N (kininase I) // Proc. Natl. Acad. Sci. USA.- 1982. – 79. – P. 4618– 4622.
64. Marino P.L. Интенсивная терапия: Пер. с англ. – М., 1998.
65. Masuda S., Hattori A., Matsbmoto H., Miyazawa S., Natori Y., Mizutani S., Tsujimoto M. In volvemtnt of the V![]() receptor in vasopressinstimulated translocation of placental leucine aminopeptidase /oxytocinase in renal cells // Eur J.Biochem. – 2003. – Vol. 270, № 9. – Р. 1988– 1994.
receptor in vasopressinstimulated translocation of placental leucine aminopeptidase /oxytocinase in renal cells // Eur J.Biochem. – 2003. – Vol. 270, № 9. – Р. 1988– 1994.
66. Plummer T.H., Ryan T.J. A potent mercapto bi-product analogue for human carboxypeptidase N // Biochem. Biophys. Res. Commun. – 1981. – № 98. – P. 448– 454.
67. Ramchandran R., Kasturi S., Douglas J.G., Sen I. Am. J. Physiol. - Heart and Circulatory Physiology. – 1996. – №40. – Р. 744– 751.
68. Skidgel R.A., Erdos E.G. Cellular carboxypeptidases // Immunol. Rev. – 1998. – V. 161, № 2. – P. 129-141
69. Skidgel R.A., Johnson A.R., Erdos E.G. Hydrolisys of opioid hexapeptides by carboxypeptidase N. Presence of carboxypeptidase in cell membranes // Biochem. Pharmacol. – 1984. – 33, № 21. – P. 3471– 3478.
70. Skidgel R.A., Tan F. Structural features of two kininase I-type enzymes revealed by molecular cloning // Agents Actions Suppl. – 1992. – 38, N 1. – P. 359-367.
71. Steiner D.F. The biosynthesis of biologically active peptides: a perspective // Peptide Biosynthesis and Processing (Fricker L.D., ed.).- CRC Press, Boca Raton, Florida, 1991. – P. 1-16.
72. Sugimura K., Tian X-L. Hoffmann S., Ganten D., Bader M. Biochem. Biophys. Res. Commun. – 1998. – 247. – Р. 466-472.
73. The Kallikrein - Kinin System in Health and Disease. Munich: Limbach - Verlag Braunschweig. – 1989. – p. 374.
74. Uehara M., Kishikawa H., Isomi S., Kisanuki K., Ohkubo Y., Miyamura N., Miyata T., Yano T. and Shiciri M. Diabetologia. – 1994. – 37. – Р. 300-307.
75. Van Sande M., Hendriks D., Soons J., Scharpe S., Wevers R., Holmquist B. Post synthetic modificati-on of CK-MM by kininase I // Adv. Exp. Med. Biol. – 1989. – 247A. – P. 319– 324.
76. Wevers R.A., Boegheim J.P., Hommes O.R., Van Landeghem A.A., Mul-Steinbusch M.W., Van der Stappen J.W., Soon J.B. A study on post-synthetic modification in alpha-alpha enolase brought about by a human serum prtotein // Clin. Chem. Acta. – 1984. – 139. – P. 127-135.
0 комментариев