Навигация
Растворение твердых веществ
СОДЕРЖАНИЕ
ОСНОВНЫЕ УСЛОВНЫЕ ОБОЗНАЧЕНИЯ
ВВЕДЕНИЕ
I. ОБЩИЕ ПОЛОЖЕНИЯ
1.1 Растворение как гетерогенный химический процесс
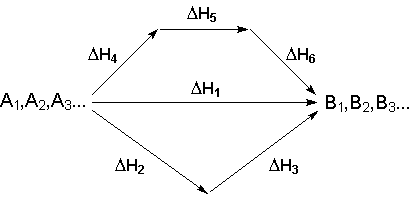
1.2 Уравнения кинетики растворения
II. ЭКСПЕРИМЕНТАЛЬНОЕ ОПРЕДЕЛЕНИЕ КИНЕТИЧЕСКИХ ХАРАКТЕРИСТИК
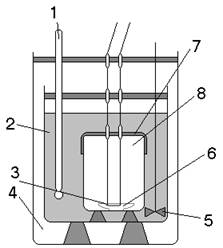
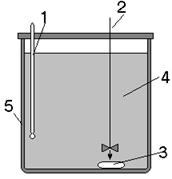
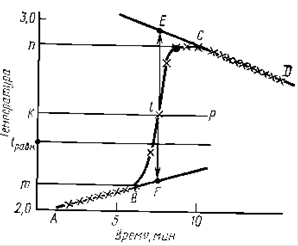
2.1 Определение энергии активации
2.2 Определение порядка реакции
2.3 Определение кинетической функции
2.4 Определение времени полного растворения
2.5 Рекомендации по проведению исследований и выполнению расчетов
III. ПРОСТЫЕ МОДЕЛИ РАСТВОРЕНИЯ И ВЫЩЕЛАЧИВАНИЯ
3.1 Определение времени полного растворения при наличии перемешивания3.2 Идентификация кинетических параметров процессов растворения
ВЫВОДЫ
ЛИТЕРАТУРА
ОСНОВНЫЕ УСЛОВНЫЕ ОБОЗНАЧЕНИЯ
Е – энергия активации;
![]() - зависимость скорости растворения от температуры;
- зависимость скорости растворения от температуры;
![]() - зависимость скорости растворения от концентрации;
- зависимость скорости растворения от концентрации;
n - cкорость вращения мешалки;
![]() - время;
- время;
Т - температура;
х - безразмерное время, равное отношению текущего времени ![]() ко времени полного растворения
ко времени полного растворения ![]() .
.
![]() - порядок реакции;
- порядок реакции;
![]() - коэффициент массоотдачи;
- коэффициент массоотдачи;
![]() - степень растворения;
- степень растворения;
![]() - доля нерастворившегося компонента в периодическом процессе;
- доля нерастворившегося компонента в периодическом процессе;
![]() - кинетическая функция.
- кинетическая функция.
ВВЕДЕНИЕ
Тема контрольной работы «Растворение твердых веществ» по дисциплине «Химическая технология неорганических веществ».
Под термином растворение понимают гетерогенные реакции, протекающие между твердым веществом и жидкостью и сопровождающиеся переходом твердого вещества в раствор. Наиболее часто этот процесс используется в химической промышленности, но он играет важную роль и в металлургической, пищевой промышленности и даже в машино- и приборостроении.
В данной работе рассмотрены основные кинетические закономерности процесса растворения твердых тел, приведена одна из методик экспериментального определения кинетических параметров растворения (константы скорости, энергии активации, порядка реакции) и оценки влияния интенсивности перемешивания на скорость растворения.
I. ОБЩИЕ ПОЛОЖЕНИЯ
1.1 Растворение как гетерогенный химический процесс
Растворение твердых тел – один из важнейших процессов химической технологи. Непосредственный результат растворения заключается в получении раствора, т.е. гомогенной смеси двух и более веществ. Обычно взаимодействие растворителя с полностью растворяющейся твердой фазой происходит на поверхности частиц, в ряде случав это взаимодействие может затрагивать пористую структуру внутри частиц. Можно выделить два основных класса реакций растворения:
1. Обратимое растворение;
2. Необратимое растворение.
Обратимое растворение сводится к образованию сольватов на поверхности реагирующей твердой фазы и переносу их в раствор. Обратимость этого процесса заключается в том, что полученный раствор можно кристаллизацией разделить на исходные реагенты. Примером такого процесса является растворение ионных кристаллов в воде с образованием пересыщенных растворов и их кристаллизация.
Необратимое растворение можно по типу реакций разбить на 3 подгруппы:
а) реакции, сводящиеся к образованию сольватов на поверхности и последующему переносу их в раствор. По своему типу эти реакции могут быть сходными с теми, которые наблюдаются при обратимом растворении. Однако полученный раствор уже нельзя кристаллизацией разделить на исходные компоненты. Примером таких реакций может служить растворение смешанных кристаллов, состоящих из ионных молекул, либо стекол в полярных и неполярных жидкостях;
б) окислительно-восстановительные реакции, приводящие к образованию сольватированных ионов и продуктов восстановления окислителя. К такого рода реакциям относятся взаимодействие металлов или их сплавов с окислителями или комплексообразователями в водных растворах;
в) реакции присоединения, замещения, нейтрализации. К этой подгруппе относятся реакции взаимодействия молекулярных и ионных кристаллов с полярными и неполярными жидкостями, приводящие к образованию сольватированных молекул и ионов.
Все эти реакции объединяет общее для гетерогенных процессов свойство: реакции растворения всегда включают в себя несколько стадий. Первой из них является стадия переноса растворителя к поверхности растворяющегося вещества, на которой происходит реакция; на второй стадии происходит собственно химическая реакция; третья стадия заключается в отводе продуктов реакции от реакционной поверхности.
Суммарная скорость процесса растворения определяется скоростями отдельных стадий. Если скорость одной из стадий процесса существенно меньше, чем скорость других, суммарная скорость процесса будет определяться скоростью именно этой наиболее медленной стадии. В том случае, когда медленной (лимитирующей) стадией является химическое взаимодействие, концентрация реагирующего вещества у поверхности совпадает с концентрацией в объеме, а наблюдаемая скорость реакции зависит от внешних параметров (т.е. от температуры и концентрации) точно также, как и истинная скорость реакции на поверхности. Такую предельную область гетерогенного процесса принято называть кинетической.
Если же медленной стадией процесса является подвод реагентов к поверхности или отвод продуктов реакции от поверхности, то скорость процесса определяется скоростью диффузии, и макроскопическая кинетика реакции не имеет ничего общего с истинной кинетикой на поверхности. Эту предельную область гетерогенного процесса называют диффузионной.
Наконец, если скорости отдельных стадий сравнимы между собой, то процесс протекает в переходной области, и наблюдаемая скорость процесса определяется как скоростью диффузии, так и скоростью химической реакции на поверхности растворяющегося вещества.
Похожие работы
... циклов. Как уже было отмечено, калориметрия используется для определения тепловых эффектов реакций, в частности она используется и для определения теплот растворения солей или других соединений в воде или других растворителях. Это является одной из самых интересных задач термохимии, так как выделение теплоты при растворении солей может быть использовано для разогрева или охлаждения тех или иных ...
... или кислот; так получают, например, золь гидроксида железа(III), имеющий следующее строение: {[Fe(OH)3]m n FeO+ · (n–x)Cl–}x+ x Cl– 4.2.2 Агрегативная устойчивость лиофобных коллоидов. Строение коллоидной мицеллы Лиофобные коллоиды обладают очень высокой поверхностной энергией и являются поэтому термодинамически неустойчивыми; это делает возможным самопроизвольный процесс уменьшения ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
... реакции на альдегидную группу – окисляется оксидом серебра (1), присоединяет синильную кислоту (4): Химические свойства: 1. 2. 3. 4. 5. 6. 7. 8. Спиртовое брожение. Эта реакция характерна для гексоз. Она осуществляется с помощью биологических катализаторов – ферментов. При сбраживании гексозы превращаются в этиловый спирт. Для пентоз брожение ...






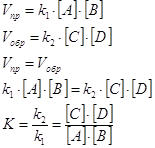
0 комментариев