Навигация
Определение кинетической функции
2.3 Определение кинетической функции
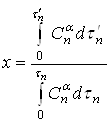
Для описания растворения необходима кинетическая характеристика процесса растворения. Выразим время в безразмерных единицах – в долях времени полного растворения ![]() . Безразмерное время, равное отношению продолжительности растворения
. Безразмерное время, равное отношению продолжительности растворения ![]() к времени полного растворения
к времени полного растворения ![]() , обозначим через х:
, обозначим через х:
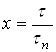 .
.
В качестве кинетической характеристики процесса удобно использовать зависимость доли нерастворившегося компонента ![]() от безразмерного времени х при постоянных концентрациях и температуре. Зависимость
от безразмерного времени х при постоянных концентрациях и температуре. Зависимость ![]() называется кинетической функцией.
называется кинетической функцией.
Результаты периодического опыта дают зависимость доли нерастворившегося продукта ![]() от времени
от времени ![]() , для получения кинетической функции
, для получения кинетической функции ![]() достаточно выразить время в безразмерных единицах
достаточно выразить время в безразмерных единицах 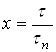 , причем время полного растворения
, причем время полного растворения ![]() определяют в том же опыте.
определяют в том же опыте.
Подобный способ с известным приближением можно применять в тех случаях, когда изменения концентрации активного реагента в ходе растворения малы (например при большом избытке активного реагента).
Для определения кинетической функции могут быть использованы результаты любого периодического опыта, проведенного при постоянных значениях концентрации активного реагента и температуры. Методика определения сводиться к следующему.
1. Результаты периодического опыта представляют в виде зависимостей доли нерастворившегося компонента ![]() и концентрации активного реагента
и концентрации активного реагента ![]() от времени
от времени ![]() :
: ![]() и
и ![]() .
.
Эти зависимости можно представить в виде графиков, таблиц или уравнений, в соответствии с выбранным способом вычисления интегралов. Безразмерное время х, соответствующее любому значению ![]() рассчитывают, пользуясь уравнением:
рассчитывают, пользуясь уравнением:
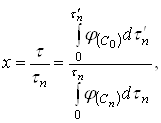 (18)
(18)
где ![]() - время, необходимое для достижения любого значения
- время, необходимое для достижения любого значения ![]() в условиях периодического опыта, т.е. при переменной концентрации активного реагента
в условиях периодического опыта, т.е. при переменной концентрации активного реагента ![]() .
.
2. По уравнению (18) вычисляют значение х, отвечающее определенному значению ![]() .
.
При этом верхний предел интеграла, стоящий в числителе, означает время необходимое для достижения этого значения ![]() в периодическом опыте. Такие вычисления проводят для ряда последовательных значений доли нерастворившегося компонента
в периодическом опыте. Такие вычисления проводят для ряда последовательных значений доли нерастворившегося компонента ![]() . Результаты расчетов, представленные в виде графика, таблицы или апроксимированные аналитическим выражением, дают кинетическую функцию
. Результаты расчетов, представленные в виде графика, таблицы или апроксимированные аналитическим выражением, дают кинетическую функцию ![]()
Графический вариант описанного метода иллюстрируется рис.1
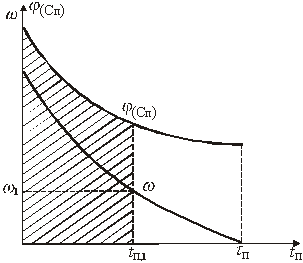
Рис.1. К графическому определению кинетической функции
Значение х соответствующее некоторому ![]() , равно отношению заштрихованной площади ко всей площади под кривой
, равно отношению заштрихованной площади ко всей площади под кривой ![]() . С помощью такого графика можно легко определить значение х для ряда значений
. С помощью такого графика можно легко определить значение х для ряда значений ![]() и составить таблицу или построить график зависимости
и составить таблицу или построить график зависимости ![]() .
.
 (19)
(19)
Входящие в уравнение (18) и (19) интегралы могут быть определены численными или графическими методами. Необходимая для выполнения интегрирования зависимость ![]() от
от ![]() , а также связь между
, а также связь между ![]() и
и ![]() , содержатся в результатах периодического опыта.
, содержатся в результатах периодического опыта.
Таким образом, уравнение (18) позволяет вычислить значения, отвечающие любому значению ![]() , и тем самым определить кинетическую функцию.
, и тем самым определить кинетическую функцию.
Похожие работы
... циклов. Как уже было отмечено, калориметрия используется для определения тепловых эффектов реакций, в частности она используется и для определения теплот растворения солей или других соединений в воде или других растворителях. Это является одной из самых интересных задач термохимии, так как выделение теплоты при растворении солей может быть использовано для разогрева или охлаждения тех или иных ...
... или кислот; так получают, например, золь гидроксида железа(III), имеющий следующее строение: {[Fe(OH)3]m n FeO+ · (n–x)Cl–}x+ x Cl– 4.2.2 Агрегативная устойчивость лиофобных коллоидов. Строение коллоидной мицеллы Лиофобные коллоиды обладают очень высокой поверхностной энергией и являются поэтому термодинамически неустойчивыми; это делает возможным самопроизвольный процесс уменьшения ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
... реакции на альдегидную группу – окисляется оксидом серебра (1), присоединяет синильную кислоту (4): Химические свойства: 1. 2. 3. 4. 5. 6. 7. 8. Спиртовое брожение. Эта реакция характерна для гексоз. Она осуществляется с помощью биологических катализаторов – ферментов. При сбраживании гексозы превращаются в этиловый спирт. Для пентоз брожение ...






0 комментариев