Навигация
Строение расплавов систем хлорид (фторид) самария - хлорид (фторид) щелочного металла
2.2 Строение расплавов систем хлорид (фторид) самария - хлорид (фторид) щелочного металла.
Под строением ионного расплава понимают состав и взаимное расположение частиц, из которых он состоит [ 20 ].
Первые выводы о строении ионных расплавов были сделаны на основании изучения их физико-химических свойств: электропроводности, вязкости, плотности и поверхностного натяжения, чисел переноса и ЭДС гальванических элементов и др. Ценную информацию можно получить при рассмотрении диаграмм состав - свойство, экстремальные точки на которых свидетельствуют о химических взаимодействиях в исследуемых системах.
Значительный прогресс в наших представлениях о строении ионных расплавов был достигнут в результате рентгеноструктурных и спектроскопических исследований. Вопреки прежним предположениям, в соответствии с которыми жидкости вообще и ионные расплавы в частности считались отдаленными аналогами газов, из рентгеновских исследований вытекает, что их нужно рассматривать как аналоги твердых кристаллических веществ.
Лантаноиды образуют устойчивые трехвалентные комплексы [ 15 ] типа МеIMeIIIF4 (MeI - Li, Na, K) и Ме3IМеIIIF6 (МеI - K, Rb, Cs, NH4). Если соотношение радиусов катионов Ме+/Ме3+ больше 1,43, то будут образовываться конгруэнтно плавящиеся комплексы типа Ме3IМеIIIF6 .
Особенности образования соединений с различной координацией ионов фтора в расплавленном состоянии подтверждаются также результатами измерений плотности и электропроводности фторидных смесей. С уменьшением радиуса иона - комплексообразователя - РЗЭ - устойчивость фторидных комплексов возрастает.
Отсутствие экстремумов на изотермах мольного объема и молярной электропроводности для систем KF - LaF3 и KF - NdF3 объясняется непрочностью фторидных комплексов KЭF4, образующихся в расплаве [ 21 ]. Минимумы на соответствующих изотермах для систем KF - YF3 и KF - GdF3 отвечают составу, содержащему 25 % мол. YF3 и GdF3. Такой состав соответствует наиболее плотной упаковке ионов, которую можно объяснить высокой устойчивостью фторидных комплексов криолитового типа K3ЭF6, где Э - Y3+, Gd3+.
Для всех расплавленных смесей имеет место отклонение величин мольного объема от аддитивности. Величина молярной электропроводности в указанных выше системах понижается с повышением мольно-долевой концентрации фторида РЗЭ. Это явление, по-видимому, объясняется присутствием в растворе наряду с простыми ионами комплексных ионов типа ЭF4- и ЭF63-.
Характер зависимости свойств (молярного объема, молярной электропроводности, поверхностного натяжения, избыточной свободной энергии и адсорбции Гиббса) исследованных систем LiCl - KCl - LnCl3 (Ln - Y, La, Ce, Pr, Nd, Sm, Gd, Dy, Er, Yb) от состава объясняется образованием в расплавах при различном содержании хлоридов лантаноидов комплексных ионов LnCl63-, LnCl52-, Ln2Cl93-, Ln2Cl7- и Ln3Cl10- [ 22 ]. Анализ построенных изотерм позволил сделать также вывод об увеличении прочности ионов LnCl63- с повышением порядкового номера в ряду лантаноидов. Для смесей с небольшим содержанием хлоридов РЗЭ цериевой группы, гадолиния или иттрия характерным является разрушение в поверхностном слое расплава комплексных ионов LnCl63-, что отражается в положительных отклонениях поверхностного натяжения от значений, рассчитанных по уравнению Жуховицкого - Гуггенгейма и объясняется понижением прочности ионов при вытеснении их на поверхность за счет несимметричности второй координационной сферы и деформации комплексных ионов.
При малом содержании SmCl3 в системе LiCl - KCl - SmCl3 понижение электропроводности можно объяснить образованием в расплаве малоподвижных комплексных анионов SmCl63-, существование которых в бинарных системах отмечено авторами [ 23 ]. В области 15-65% (мол.) SmCl3 в исследуемой солевой системе, наряду с SmCl63- , образуются анионы SmCl52-. При концентрации трихлорида самария выше 65% мол. в системе LiCl - KCl - SmCl3 возможно образование более сложных комплексных анионов Sm2Cl7-. Существование в бинарных смесях хлорид самария - хлорид щелочного металла анионов SmCl52- и Sm2Cl7- установлено в работах [ 23, 24 ] . Кроме того, на возможность существования в расплавленных смесях SmCl3 с хлоридами щелочных металлов ионов SmCl63-, SmCl52- и Sm2Cl7- указывают результаты исследования диаграмм плавкости бинарных систем, при изучении которых обнаружены соединения Me3SmCl6, Me2SmCl5, MeSm2Cl7 (Me - щелочной металл).
2.3 Электропроводность, поверхностное натяжение, плотность расплавов хлорид (фторид) самария - хлорид (фторид) щелочного металла.
Значительное сходство физических и химических свойств РЗЭ обусловлено одинаковым числом электронов в двух внешних слоях. Обычно атомы РЗЭ сравнительно легко отдают по три электрона, образуя Ln3+ - ионы. Остальнвые 4f-электроны, как правило, в образовании химических связей не участвуют; исключением являются Ce, Pr, Tb. Под влиянием полей соседних ионов 4f-электроны могут претерпеть некоторое возмущение, но оно не велико вследствие экранирующего действия, оказываемого электронами пятого слоя, имеющимися у всех ионов РЗЭ.
Электроны 4f-подуровня оказывают второстепенное влияние на химические свойства, но обуславливают ряд характерных для РЗЭ физико-химических свойств: цветность, парамагнетизм и др. Некоторые из этих свойств при переходе от одного элемента к другому изменяются постепенно, непрерывно, для других свойств наблюдается периодическое изменение [ 25 ]. К группе непрерывно изменяющихся свойств относятся такие свойства ионов или атомов, как ионные и кристаллические радиусы, атомные и мольные объемы, основность, показатели преломления и ионизационные потенциалы. К группе периодически изменяющихся свойств можно отнести парамагнетизм, окраску ионов, изменение валентности и т.д.
Тригалогениды обладают довольно высокой температурой плавления и малой летучестью. Последняя, как правило, увеличивается с возрастанием порядкового номера РЗЭ. Трихлориды лантаноидов наибольших порядковых номеров имеют значительную летучесть, но менее резко выраженную, чем у ScCl3. Температура плавления тригалогенидов в ряду лантаноидов сначала уменьшается, а затем снова увеличивается, то есть кривые зависимости температуры плавления от порядкового номера элементов проходят через минимум, который сдвигается в сторону лантаноидов с меньшим порядковым номером от трихлоридов к трииодидам через трибромиды; для трифторидов температуры плавления уменьшаются до конца ряда лантаноидов.
У всех трихлоридов РЗМ наблюдается линейная зависимость удельной электропроводности от температуры. Найденные по методу наименьших квадратов значения статистических коэффициентов a и b и рассчитанные по ним значения удельной электропроводности трихлоридов РЗМ при 900(С [ 26 ] приведены в табл. N5.
Таблица N5
Значения статистических коэффициентов
a и b в уравнении
x=a+bT для трихлоридов РЗМ.
LnCl3
-a
b(103
Темп. интер вал,(С
(900(C),
Ом-1(см-1
LaCl3
1,422
3,04
855-960
1,314
CeCl3
1,155
2,74
824-939 1,311 PrCl3 1,247 2,82 773-908 1,291 NdCl3 0,842 2,14 765-926 1,084 SmCl3 1,005 2,39 644-822 1,146 EuCl3 0,963 2,39 625-810 1,189 GdCl3 0,796 1,85 610-883 0,869 TbCl3 0,896 1,94 583-898 0,850 DyCl3 0,963 1,94 642-851 0,783 HoCl3 0,929 1,82 719-931 0,709 ErCl3 1,022 1,87 756-952 0,661 TmCl3 1,027 1,79 794-992 0,584 YbCl3 0,876 1,77 850-960 0,715 LuCl3 1,051 1,69 884-1005 0,470
Электропроводность трихлоридов в ряду от лантана до лютеция (рис. 2.4) уменьшается, что объясняется возрастающей способностью к комплексообразованию ионов Ln3+ за счет лантаноидного сжатия. Однако изменение электропроводности в ряду РЗМ немонотонно. Можно четко выделить четыре сегмента: La - Nd, Nd - Gd, Gd - Ho, Ho - Lu (по два в цериевой и иттриевой подгруппах РЗМ). Подобное деление ряда РЗМ получило название "тетрадного эффекта" [ 27, 28 ], обусловленного дестабилизацией ионов Nd3+, Gd3+, Ho3+. Аномально высокие значения электропроводности трихлоридов Sm, Eu, Yb объясняются устойчивостью двухвалентных ионов данных РЗМ как в твердом, так и в жидком состояниях, обладающих меньшей способностью к комплексообразованию.
Для всех исследованных составов системы LiCl - KCl - SmCl3 температурные зависимости удельной электропроводности ( ), плотности (() и поверхностного натяжения (() описываются уравнениями вида [ 29 ]:
x = a + bT ( 1 )
Значения коэффициентов уравнений находятся методом наименьших квадратов; они приведены в таблице N6. Из экспериментальных данных по плотности и удельной электропроводности рассчитаны значения молярной электропроводности ((). На рис. 2.5 показана изотерма молярной электропроводности расплава LiCl - KCl - SmCl3 при 1050К. Как видим, при добавлении 10-15% (мол.) SmCl3 молярная электропроводность смеси резко падает. При содержании в расплаве 15-65% (мол.) SmCl3 молярная электропроводность системы изменяется незначительно. Дальнейшее увеличение концентрации трихлорида самария приводит к более резкому снижению молярной электропроводности. Подобная зависимость молярной электропроводности от состава наблюдается в системах LiCl - KCl - PrCl3 [ 30 ] и LiCl - KCl - NdCl3 [ 31 ].
Таблица N6
SmCl3,
% мол. а b(103 ((xТемператур. интервал, К 1 2 3 4 5 (10-2, Ом-1(м-1 2,34 -1,465 4,135 0,029 770-1070 8,45 -1,468 3,756 0,007 770-1070 17,71 -1,163 3,098 0,011 770-1070 33,43 -1,470 2,933 0,009 860-1070 46,27 -1,723 3,018 0,012 840-1070 65.96 -1,802 2,858 0,015 820-1070 77,13 -1,879 2,856 0,011 870-1070 87,44 -1,842 2,658 0,009 910-1070 100 -1.768 2,449 0,004 960-1070 ((10-3, кг/м3 2,34 2,136 -0,540 0,009 770-!070 8,45 2,409 -0,638 0,012 770-1070 17,71 2,635 -0,648 0,009 770-1070 33,43 2,886 -0,636 0,009 860-1070 46,27 3,204 -0,714 0,011 840-1070 65,96 3,608 -0,762 0,008 820-1070 77,13 3,828 -0,800 0,010 870-1070 87,44 3,977 -0,783 0,012 910-1070 1 2 3 4 5 ((103, Н/м 2,34 134,8 -24,6 0,3 770-1070 8,45 128,9 -28,5 0,6 770-1070 17,71 127,5 -37,3 0,5 770-1070 33,43 154,3 -63,2 0,4 860-1070 46,27 148,0 -56,7 0,6 840-1070 65,96 136.9 -44,7 0,8 820-1070 77,13 147.0 -53,2 0,7 870-1070 87,44 172,9 -77,0 0,6 910-1070 100 218,5 -119,6 0,5 960-1070
На рис. 2.6 показана изотерма поверхностного натяжения системы LiCl - KCl - SmCl3, построенная по экспериментальным данным для 1050К (см. табл. N6). Штриховой линией изображена изотерма, рассчитанная по уравнению Жуховицкого - Гуггенгейма для идеального раствора. Как видим, изотерма поверхностного натяжения имеет экстремальный вид с максимумом в области малых концентраций SmCl3, что можно объяснить протеканием в расплаве следуюших процессов. При добавлении в эвтектику LiCl - KCl хлорида самария происходит вытеснение ионов Li+ из первой координационной сферы во вторую с образованием комплексных ионов типа SmCl63-. Это ведет к накоплению в расплаве относительно "свободных" катионов Li+ и увеличению поверхностного натяжения расплава по сравнению с рассчитанным для идеального раствора. При повышении концентрации SmCl3 в смеси уменьшается число "свободных" катионов Li+ , растет число комплексных ионов на основе катиона Sm3+ , поверхностное натяжение при этом резко уменьшается. В дальнейшем, по мере роста концентрации в расплаве трихлорида самария происходит перестройка комплексных ионов. Образуются ионы SmCl52-, Sm2Cl7-, что приводит к отрицательным отклонениям поверхностного натяжения по сравнению с рассчитанным по уравнению для идеального раствора.
В последнее время были проведены исследования взаимодействия в системах РЗМ - солевой расплав; также исследовались термодинамические свойства систем РЗЭ с другими металлами. Для примера приведем системы Ln - Co и Ln - Ni.
В качестве характеристики взаимодействия металлов с Ni и Co [ 22 ] использовали изменение массы образца - подложки (Ni или Co), которая в исследованных условиях описывается уравнением вида:
P = K(n ( 2 )
где Р - изменение массы образца; ( - продолжительность процесса; n - показатель степени; К - константа скорости процесса:
E
K = K0 exp ( ( ) ( 3 )
RT
Т - температура процесса; К0 - коэффициент; R - универсальная газовая постоянная; Е - энергия активации процесса.
Анализ уравнения ( 2 ) показал, что для большинства исследованных систем Ме - Ln (Mе - Co, Ni; Ln - Y, La, Ce, Pr) значения показателя степени n близки к 0,5. Параболическая зависимоть изменения массы образцов от времени свидетельствует о том, что лимитирующей стадией процесса является диффузия в твердой фазе. Константа скорости К, при одинаковых температурах, в 3-5 раз выше для систем Co - Ln. Наименьшее значение К наблюдается при образовании сплавов лантана. Энергия активации процесса Е максимальна для системы Co - Pr (95(5) и минимальна для системы Ni - La (54(2)кДж/моль.
Исследование взаимодействия РЗЭ и их цинковых сплавов с расплавом LiCl - KCl показало, что скорость коррозии РЗЭ из цинковых сплавов значительно ниже скорости коррозии металлов и при 973К для большинства РЗЭ составляет (3-5)(10-3, для Sm - 12(10-3 и для Yb - 38(10-3 г/см2(ч.
В литературе есть сведения о термодинамических свойствах соединений самария, богатых легкоплавким металлом (ЛПМ) [ 32 ]. Однако они получены измерениями ЭДС гальванического элемента
Sm - Inн.р. | KCl - LiCl + SmCl2 | Sm - ЛПМн.р. ( 4 )
в котором для пересчета использованы сплавы Sm c Zn c известными термодинамическими свойствами [ 33 ]. По результатам прямых измерений потенциалов насыщенных растворов Sm - In и Sm - Bi относительно металлического самария для реакций
Sm(тв.) + 2In(ж.) ( SmIn2(тв.) ( 5 )
Sm(тв.) + 2Bi(ж.) ( SmBi2(тв.) ( 6 )
рассчитаны [ 34 ] температурные зависимости парциальных значений энергий Гиббса самария в соединениях SmIn2 и SmBi2.
_
SmIn2 (GSm = -258,3 + 130,2(10-3T ( 0,2 (кДж/моль) ( 7 )
_
SmBi2 (GSm = -247,8 + 71,9(10-3T ( 0,2 (кДж/моль) ( 8 )
С учетом зависимостей ( 7 ), ( 8 ) и результатов измерений ЭДС гальванического элемента ( 4 ), получены новые значения термодинамических характеристик соединений самария с ЛПМ.
рис. 2.4.
Электропроводность трихлоридов РЗМ.
рис. 2.5.
Изотерма молярной электропроводности расплава LiCl - KCl - SmCl3 при 1050К.
рис. 2.6.
Изотерма поверхностного натяжения системы LiCl - KCl - SmCl3 (Т=1050К).
Похожие работы
... (tпл. GdCl3 = 610˚C), остывший трихлорид хранили в герметически закрытых ампулах. Все операции с солью проводились в сухом боксе. Глава Ш. Исследование совместного электровосстановления гадолиния и алюминия в галогенидных расплавах. Из анализа литературных данных следует, что процесс электровосстановления алюминия из хлоридных и фторидных расплавов изучался в основном на платиновом ...
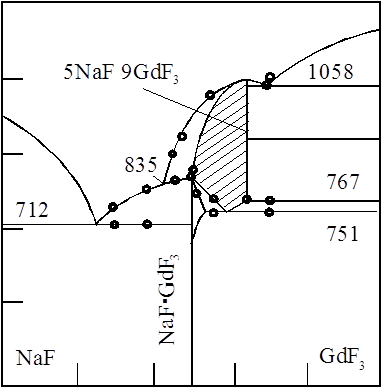
0 комментариев