Навигация
Вольтамперные измерения на серебряном электроде в самарийсодержащих хлоридных расплавах
4.1 Вольтамперные измерения на серебряном электроде в самарийсодержащих хлоридных расплавах.
На рис. 4.1 представлены хроновольтамперные кривые расплава KCl - NaCl при последовательном добавлении трихлорида самария на серебряном электроде.
Кривая 1 представляет собой вольтамперную зависимость фонового электролита. Отсутствие волн на ней и малые значения остаточного тока при достаточно больших отрицательных потенциалах позволяет нам сделать вывод о том, что фоновый электролит не содержит каких-либо примесей.
Добавление трихлорида самария в количестве порядка 5(10-5 моль/см3 приводит к появлению на хроновольтамперной кривой двух волн восстановления: первая при потенциалах -(1,7-1,9)В, вторая - при -(2,0-2,1)В. С увеличением концентрации SmCl3 высота обеих волн растет, причем вторая волна растет более интенсивно.
На рис. 4.2 представлены вольтамперные кривые хлоридного расплава при скоростях поляризации от 0,01 до 0,5 В/с. Концентрация трихлорида самария постоянна и составляет 2,12(10-4 моль/см3. При малых скоростях поляризации первая волна восстановления проявляется с плохой воспроизводимостью и становится в достаточной степени воспроизводимой при V > 0,05 В/с. С увеличением скорости поляризации высота волны растет и наблюдается ее сдвиг по оси потенциала в отрицательную область относительно потенциала выделения щелочного металла. Вторая волна устойчиво воспроизводится во всем интервале скоростей поляризации и растет с увеличением V; при этом также наблюдается ее смещение в область отрицательных потенциалов.
На рис. 4.3 - 4.5 представлены циклические вольтамперограммы расплава KCl - NaCl - SmCl3 в интервале концентраций трихлорида самария (1,33-1,743)(10-4 моль/см3 и скоростях поляризации от 0,1 до 0,5 В/с. Разность потенциалов катодного и анодного пиков характеризует степень обратимости процесса, а в целом циклическая зависимость позволяет судить о механизме процесса электровосстановления.
При потенциалах возврата, больших -(2,2-2,3)В, отвечающих восстановлению щелочного металла, в анодной части кривых наблюдается две волны анодного растворения: первая - при потенциалах -(2,1-2,2)В; вторая - при -(1,8-1,9)В. Первая волна отвечает растворению щелочного металла, вторая - самария. С увеличением концентрации SmCl3 в расплаве и скорости развертки потенциала высота волны анодного растворения самария растет. Потенциал пика анодного растворения зависит как от скорости поляризации, так и от потенциала возврата.
При потенциалах срыва, отвечающих первой волне катодного восстановления самария, волна анодного растворения отсутствует, и как видно из рис. 4.5, анодная волна появляется лишь при потенциалах возврата, отвечающих второй волне катодного восстановления.
4.2 Вольтамперные измерения на платиновом электроде в самарийсодержащих хлоридных расплавах.
На рис. 4.6 представлены хроновольтамперограммы расплава KCl - NaCl - SmCl3 на платиновом электроде в интервале концентраций SmCl3 от 0,495 до 2,97(10-4 моль/см3 и скорости поляризации 0,1 В/с. Как видим, добавление трихлорида самария в количестве 5(10-5 моль/см3 приводит к появлению на вольтамперной кривой волны восстановления при потенциалах -(1,55-1,8)В. С ростом содержания в расплаве SmCl3 высота волны увеличивается и при концентрации трихлорида (2(10-4 моль/см3 появляется растянутая по оси потенциала предволна, предшествующая основной волне восстановления самария.
На рис. 4.7 приведены циклические вольтамперные кривые хлоридного расплава в интервале концентраций SmCl3 (0,495-2,57)(10-4 моль/см3; V = 0,1 В/с. Как видно из рисунка, при добавлении в расплав трихлорида в анодной части кривой появляется волна при потенциалах -(0,4-0,6)В, которая с увеличением концентрации SmCl3 растет.
4.3 Влияние фторид-иона на процесс электровосстановления ионов самария в хлоридно - фторидных расплавах.
На рис. 4.8 представлены циклическая вольтамперная кривая расплава KCl - NaCl - SmCl3 ( 1 ) на серебряном электроде (C(SmCl3) = 1,743(10-4 моль/см3; V = 0,1 В/с) и далее хроновольтамперограммы хлоридно - фторидного расплава при последовательном добавлении NaF. Как видно из рисунка, при концентрации F- -иона (8(10-5 моль/см3 (соотношение C(SmCl3) : C(NaF)= 2:1) первая волна катодного восстановления не наблюдается; вторая же волна растет по высоте и смещается в область более отрицательных потенциалов. Что касается волны анодного растворения самария, то практически не наблюдается ее смещения по оси потенциала.
На рис. 4.9 представлены вольтамперограммы расплава KCl - NaCl - SmCl3 ( 1 ) на платиновом электроде и далее вольтамперные кривые при последовательном добавлении в систему фторида натрия. Как видим, добавление F- -иона приводит к росту волны катодного восстановления и уменьшению анодной волны растворения самария.
рис. 4.1.
Хроновольтамперограммы расплава KCl - NaCl - SmCl3 на серебряном электроде; Т=973К, V=0,1 В/с; Sкат. = 0,08 см2.
1 - фоновый электролит; С(SmCl3), моль/см3(104: 2 - 0,854; 3 - 1,33; 4 - 2,12.
рис. 4.2.
Хроновольтамперограммы расплава KCl - NaCl - SmCl3 на серебряном электроде при различных скоростях поляризации; Т=973К, С(SmCl3)=2,12(10-4 моль/см3; Sкат. = 0,08 см2.
V, В/с: 1 - 0,01; 2 - 0,02; 3 - 0,05; 4 - 0,1; 5 - 0,2; 6 - 0,5.
рис. 4.3.
Циклические вольтамперограммы расплава KCl - NaCl - SmCl3 на серебряном электроде при различных потенциалах срыва; Т=973К; С(SmCl3)=1,33(10-4 моль/см3; V=0,1 В/с; Sкат. = 0,09 см2.
1 - фоновый электролит; -(, В: 2 - 2,4; 3 - 2,25.
рис. 4.4.
Циклические вольтамперограммы расплава KCl - NaCl - SmCl3 на серебряном электроде при различных потенциалах срыва; Т=973К; С(SmCl3)=1,743(10-4 моль/см3; V=0,2 В/с; Sкат. = 0,09 см2.
-(, В: 1 - 2,3; 2 - 2,5.
рис. 4.5.
Циклические вольтамперограммы расплава KCl - NaCl - SmCl3 на серебряном электроде при различных потенциалах срыва; Т=973К; С(SmCl3)=1,743(10-4 моль/см3; V=0,5 В/с; Sкат. = 0,09 см2.
-(, В: 1 - 2,4; 2 - 2,15; 3 - 2,1.
рис. 4.6.
Хроновольтамперограммы расплава KCl - NaCl - SmCl3 на платиновом электроде; Т=973К, V=0,1 В/с; Sкат. = 0,057 см2 (кривые 4, 6, 7); Sкат. = 0,076 см2 (кривые 1, 2, 3, 5).
1 - фоновый электролит; С(SmCl3), моль/см3(104: 2 - 0,495; 3 - 1,115; 4 - 1,33; 5 - 1,743; 6 - 2,12; 7 - 2,97.
рис. 4.7.
Циклические вольтамперограммы расплава KCl - NaCl - SmCl3 на платиновом электроде при различных потенциалах срыва; Т=973К; C(SmCl3)= (0,495 - 2,97)(10-4 моль/см3; V=0,1 В/с; Sкат. = 0,057 см2 (кривые 4, 6, 7); Sкат. = 0,076 см2 (кривые 1, 2, 3, 5).
1 - фоновый электролит; -(, В: 2 - 1,8; 3 - 2,3; 4 - 2,1; 5 - 2,3; 6 - 2,1; 7 - 2,2.
рис. 4.8.
Циклические вольтамперограммы расплава KCl - NaCl - SmCl3 на серебряном электроде при последовательном добавлении NaF; Т=973К; V=0,1 В/с; Sкат. = 0,09 см2.
1 - С(SmCl3)=1,743(10-4 моль/см3; C(NaF), моль/см3(104: 2 - 0,87; 3 - 1,74.
рис. 4.9.
Циклические вольтамперограммы расплава KCl - NaCl - SmCl3 на платиновом электроде при последовательном добавлении NaF; Т=973К; V=0,1 В/с; Sкат. = 0,076 см2.
1 - С(SmCl3)=1,743(10-4 моль/см3; C(NaF), моль/см3(104: 2 - 0,87; 3 - 1,74; 4 - 8,29.
4.4 Анализ вольтамперных зависимостей по диагностическим критериям и механизм восстановления Sm3+-иона в галогенидных расплавах.
Для выяснения механизма электровосстановления ионов самария в хлоридных и хлоридно-фторидных расплавах мы провели анализ вольтамперных зависимостей на серебряном и платиновом электродах. Для этого был проведен расчет тока, потенциала первой волны и потенциала полуволны при различных концентрациях SmCl3 в расплаве и скоростях поляризации. Для выяснения характера электродного процесса на серебряном электроде по диагностическим критериям проведен расчет числа электронов n, переносимых в электродной реакции. Эти данные для серебряного электрода представлены в табл. N7, для платинового - в табл. N8.
Таблица N7
C(SmCl3), моль/см3(104V,
В/сi, мА/см2
первая волна-(k,
B-(/1/2k,
B0,4950,198,06
1,850
-
1,7430,1
0,252,78
82,50
1,955
1,9481,895
1,8752,120,01
0,02
0,05
0,1
0,29,38
21,88
37,50
68,31
97,491,865
1,870
1,880
1,880
1,890-
1,830
1,830
1,820
1,830
2,970,1
0,268,75
115,631,965
1,9551,910
1,870
Таблица N8
C(SmCl3), моль/см3(104V,
В/сi, мА/см2
первая волна-(k,
B-(/1/2k,
B0,4950,133,55
1,530
-
1,150,1
55,72
1,7051,5601,7430,1
101,981,9401,860
Отсутствие явного диффузионного пика на вольтамперных зависимостях на серебряном электроде свидетельствует о том, что процесс сопровождается химической реакцией, что также подтверждается видом кривой зависимости ip/V1/2 - V1/2, приведенной на рис. 4.10.
Анализ стационарных кривых по уравнению Гейровского - Ильковича дает число электронов для процесса, соответствующего первой волне, равное 1. Отсутствие анодной волны при потенциалах срыва, отвечающих первой волне катодного восстановления, говорит о том, что скорость последующей химической реакции значительно больше скорости развертки потенциала. С учетом сказанного можно записать уравнения электродных процессов, протекающих на первой волне катодного восстановления:
Sm3+ + e ( Sm2+ ( 1 )
2Sm2+ ( Sm3+ + Sm0 ( 2 )
На второй волне катодного восстановления происходит восстановление иона Sm3+ до металлического самария, что подтверждается появлением анодного пика при потенциалах возврата, отвечающих второй волне катодного восстановления:
SmCl63- + 3e ( Sm0 + 6Cl- ( 3 )
(существование иона Sm3+ в хлоридных расплавах при концентрациях SmCl3 0-15 мол.% в виде комплекса SmCl63- подтверждено авторами [ 29 ]).
Разность потенциалов катодной и анодной волн значительно превышает величину 2,3RT/nF, что указывает на необратимость процесса.
Анализ вольтамперных кривых на платиновом электроде позволяет сделать вывод о необратимом характере восстановления. Лимитирующей стадией процесса при скоростях поляризации (0,1 В/с является диффузия ионов к поверхности электрода. Подтверждением тому является прямо пропорциональная зависимость ток электровосстановления от концентрации SmCl3 в расплаве, приведенная на рис.4.11.
В области потенциалов -(1,0-1,5)В, соответствующей предволне в катодной части кривой, происходит сплавообразование с материалом электрода.
Анализ вольтамперных зависимостей хлоридно - фторидных расплавов позволяет сделать вывод об образовании фторидных и хлоридно - фторидных комплексов и стабилизации высшей степени окисления самария (+3):
SmCl63- + xF- ( [SmCl6-xFx]3- + xCl- ( 4 )
где x= 0-6.
SmCl63- + 6F- ( SmF63- + 6Cl- ( 5 )
На это указывает исчезновение второй волны катодного восстановления на серебряном электроде при увеличении концентрации фторид-иона в расплаве, т.е. имеет место трехэлектронный процесс, описываемый уравнением:
Sm3+ + 3e ( Sm0 ( 6 ).
рис. 4.10.
Зависимость тока пика от скорости поляризации. Катод - Ag.
рис. 4.11.
Зависимость тока электровосстановления от концентрации SmCl3 в расплаве. Катод - Pt.
5. Выводы.
1. Отработана методика получения безводного трихлорида самария.
2. Изучен механизм электровосстановления иона самария в хлоридных и хлоридно-фторидных расплавах.
3. Показано, что для серебряного электрода в хлоридных расплавах процесс восстановления протекает в две стадии, первая из которых осложнена последующей быстрой обратимой химической реакцией. В целом процесс электровосстановления необратим.
4. На платиновом электроде процесс необратимый и носит диффузионный характер при малых скоростях поляризации; в области потенциалов, соответствующих предволне, имеет место сплавообразование с материалом электрода.
5. В хлоридно - фторидных расплавах процесс электровосстановления необратим и одностадиен.
6. Список использованной литературы.
1. Thoma R.E., Karraken R.H. Ibid., 5, 1933 (1966).
2. Thoma R.E. et al. Inorg. Chem., 2, 1005 (1963).
3. Barton C. J., Redman J.D., Stehlow R.A. J. Inorg. Nucl. Chem., 20, 45 (1961).
4. Thoma R.E., Jusley H., Herbert G.M. Ibid., 5, 1222 (1966).
5. Zachariasen W.H. Ibid., 2, 388 (1949).
6. Zachariasen W.H. J. Amer. Chem. Soc., 70, 2147 (1948).
7. Zachariasen W.H. Acta Cryst., 4, 231 (1951).
8. Seards D.R. U.S. Report ORNL - 4076, p. 11 (1966).
9. Дергунов Е.П. "Докл. АН СССР", 85, 1025 (1952).
10. Буналов Г.А., Бабаева Е.П. "Ж. неорг. химии", 11, 337 (1966).
11. Brunton G.D. et al. U.S. Report ORNL - 3761 (1965).
12. Дергунов Е.П. "Докл. АН СССР", 60, 1185 (1948).
13. Bode H., Voss E. Z. Anorg. Chem., 290, 1 (1957).
14. Hoppe R. Частное сообщение (1967); Rodden K. Theses Westfalischen, Wilhelms Universitat, Munster (1963).
15. Браун Д. "Галогениды лантаноидов и актиноидов", - М., Атомиздат, 1972 - 272с.
16. Баев А.К., Новиков Г.И. "Ж. неорг. химии", 1961, 6, 11, 2610.
17. Коршунов Б.Г., Дробот Д.В. "Ж. неорг. химии", 1964, 9, 1, 222.
18. Дробот Д.В. и др. "Труды II Всесоюзного совещания по физ. химии расплавленных солей", Металлургия, М., 1985, с. 85, ЖНХ, 1965, т.10, с. 1675.
19. "Диаграммы состояния металлических систем", 1965 - 127с.
20. Делимарский Ю.К., Барчук Л.П. "Прикладная химия ионных расплавов", Киев, Наук. Думка, 1988 - 192с.
21. Простаков М.Е., Пырина В.К., Кочергин В.П. "Комплексообразование в расплавленных смесях фторидов K, Y, La, Nd и Gd". В кн. "VI Всесоюзная конференция по физ. химии ионных расплавов и тв. электролитов"; Тезисы докладов, ч.1, Киев, Наук. Думка, 1976.
22. Ковалевский В.А. "Физико-химические процессы в хлоридных расплавах, содержащих РЗЭ", в кн. "Тезисы докладов IX Всесоюзной конференции по физ. химии и электрохимии ионных расплавов и твердых электролитов", Свердловск, 1987, т.1, с. 77 - 78.
23. Forhmann R., Schneider A. A chemie der selteren erden in geschmalzenen alkalichloriden. Schmelzen von alkalichloriden mit der lantaniden PrCl3 bis YbCl3. Z. Anorg. und Allg. Chem., 1969, 367, H1/2, s. 27 - 33.
24. Савин В.Д., Михайлова Н.П. "Взаимодействие хлоридов РЗЭ с хлористым калием в расплавах".- В кн. "III Урал. науч. семинар по хим. реакциям и процессам в расплавах электролитов"; Тезисы докладов, Пермь, 1982, с. 10 - 12.
25. Серебренников В.В., Алексеенко Л.А. "Курс химии РЗЭ (Sc, Y, лантаноиды)", Томск, Изд-во Томского ун-та, 1963.
26. Кулагин Н.М., Лапшев Д.М. и др. "Тетрадный эффект в электропроводности трихлоридов РЗМ", в кн. "Тезисы докладов IX Всесоюзной конференции по физ. химии и электрохимии ионных расплавов и твердых электролитов", Свердловск, 1987, т.1, с. 79 - 80.
27. Спицын В.И., Вохлиш В.Г., Ионова Г.Б. Ж. неорг. химии, 1983, т.28, вып.4, с. 819 - 829.
28. Бандуркин Г.А., Джуринский Б.Ф., Тананаев И.В. "Особенности кристаллохимии соединений РЗЭ", отв. ред. докт. хим. наук В.И. Пахомов - М., Наука, 1984 - 229с.
29. "Физико-химические свойства расплавленных смесей эвтектики LiCl - KCl с хлоридом самария"/ Ковалевский А.В., Ничков И.Ф., Шиталов В.И. - Ионные расплавы и твердые электролиты, 1986, вып. 1, с. 37 -39.
30. Ковалевский А.В., Ничков И.Ф., Шиталов В.И. "Электропроводность, плотность и поверхностное натяжение расплавленных смесей хлоридов Li и K с хлоридом празеодима" - Изв. вузов. Цв. металлургия, 1983, N4, с. 70 - 72.
31. Ковалевский А.В., Шиталов В.И. "Физико-химические свойства расплавленных смесей хлоридов Li и K с хлоридом неодима" - Журн. физ. химии, 1983, 57, N10, с. 2597 - 2599.
32. Лебедев В.А, Ефремов В.В., Кобер В.И. и др. в кн. "Сплавы редких металлов с особыми физико-химическими свойствами", изд. Наука, М., 1975, с. 96.
33. Chiotti P., Mason J.T. Trans. Met. AIME. 1967, v.239, p. 547.
34. Кобер В.И. и др. "Термодинамические свойства сплавов самария с легкоплавкими металлами", в кн. "V Кольский семинар по электрохимии редких и цветных металлов"; Тезисы докладов, Апатиты, 1986, с. 51.
35. Серебренников В.В. "Химия РЗЭ", т.1, изд. Томского ун-та, 1959.
36. Хасэгава Иосисукэ "Киндзоку, Metals and Technol.", 1988, 58, N1, 52 - 57 (яп.).
37. "Электролитический способ производства редкоземельных металлов или их сплавов и устройство для его осуществления". Seon Francoise, Barthola Chislaino; Phone-Poulenc Specialities Chimioues, опубл. 13.06.86. МКИ С25С 1/22, 7/00.
38. Глаголевская А.Л., Кузнецов С.А. и др. "Ж. прикл. химии", 1987, 60, N4, 770 - 774.
39. "Электрохимичческое получение церия и сплава Ce - Co". Singh S., Pappachan A.L., Gadiar H.S. J. less-common metals, 1986, 120, N2, 307 - 317 (англ.).
40. Chambers M.F., Murfy J.E. // Rare earth, Extract, Preparat. and Appl. Proc. Symp. TMS Annu Mut. Las Vegas, Nev., Febr. 27 - March 2, 1989 - Warrendale (Pa), 1988 - с. 369 - 376 (англ.).
41. Лебедев В.А. и др. "Электрохимическое поведение самария в хлоридных расплавах", Электрохимия, 1974, т.10, в.9, с. 1342 - 1344.
42. Васин Б.Д. и др. "Потенциометрическое исследование самарийсодержащих хлоридных расплавов", в кн. "V Кольский семинар по электрохимии редких и цветных металлов"; Тезисы докладов, Апатиты, 1986, с. 33.
43. Диева Э.Н. В сб. "Физико-химические исследования жидких металлов и сплавов", Свердловск: УНЦ АН СССР, 1974.
44. Кобер В.И. и др. "Электрохимическое изучение растворимости самария в жидком индии", в кн. "V Кольский семинар по электрохимии редких и цветных металлов"; Тезисы докладов, Апатиты, 1986, с. 45.
45. Morzice E., New front rare earth sci and appl. proc. Int. Conf., Beijing, Sept. 10 -14, 1985. Vol. 2 Beijing, 1985, 1099 - 1100 (англ.).
46. Classification and nomenclature of electroanalitical fechniqicess / Comission of electroanalitical chemistry // Pure and appl. chem. / 1976 - 45 - p. 81-97.
47. Д. Плешбэк "Электрохимические методы анализа", М., Мир, 1985 - 496с.
48. З. Галюс "Теоретические основы электрохимического анализа", М., Мир, 1974.
49. Nicholson R.S., Shain J. Theory of stationary elektrode polarography for a chemical reaction coupled between juo charge transfers // Anal. Chem. - 1965 - 37, N2, p. 179 - 190.
50. Adams Rn. Electrochemistry at solid elektrodes. N. J: Mansel Dekken, JNC, 1969 - 402p.
51. Кушхов Х.Б. "Высокотемпературная физическая химия. Описание лабораторных работ спецпрактикума", Нальчик, 1994.
52. Saveant J.M., Vianello E., in "Advences of polarography", I, 8; Longmuir, ed., vol. 1, p. 367, Pengamon Press, New York, 1960.
53. Saveant J.M. Ecole normale superieure, Paris, private communication.
54. Делимарский Ю.К., Колотий А.А., Грищенко В.Ф. "Электродная функция платины в расплавах", 1ч. // Укр. хим. журн. - 1961 - 27, N6 - с. 760 - 766.
55. Делимарский Ю.К., Колотий А.А. "Электродная функция платины в расплавах", 2ч. // Укр. хим. журн. - 1962 - 28, N1 - с. 53 -58.
56. Flood H., Forland T. "Some investigation on the oxygen overpotential in molten salts" // Disk. Farad. Soc. 1947 - N1 - p. 302 -307.
57. Carlson O.N., Shmidt F.A. In the rare earth(Spedding F.H., Daane A.H., Eds), Wiley, New York, 1961, Chap. 6, p. 77.
58. Spedding F.H., Daane A.H., In progr. nucl. energy ser. V, 1, 413 (Finniston H.M., Howe J.R., Eds), Pengamon, London, 1956.
59. Zalkin A., Templeton D.H. J. Amer. Chem. Soc., 75, 2453 (1953).
60. Walker J., Olsen E. U.S. Report IS - 2 (1959).
61. Thoma R.E., Brunton G.D. Ibid., 5, 1937 (1966).
62. Popovici J. Chem. Ber., 41, 634 (1908).
63. Daane A.H., Spedding F.H. J. Electrochem. Soc., 100, 442 (1953).
64. Staritzky E., Aspley L.B. Anal. Chem., 29, 855, 856 (1957).
65. Weigel F., Sherrer V. Radiochim. Acta, 7, 40 (1967).
66. Tischer R.L., Burnet G. U.S. Report IS - 8 (1959).
67. Popov A.J., Kundson G.E. J. Amer. Chem. Soc., 76, 3921 (1954).
68. Muetterties E.L., Castle J.E. J. Inorg. Nucl. Chem., 18, 148 (1961).
69. Johnson O. et al. U.S. Report TID - 5290, p. 1 (1958).
70. Druding D.F., Corbett J.D. J. Amer. Chem. Soc., 83, 2462 (1961).
71. Druding D.F., Corbett J.D. Ibid., 81, 5512 (1959).
72. Banks C.V. et al. U.S. Report IS - 1 (1959).
73. Corbett J.D., Ramsey B.N. Inorg. Chem., 4, 260 (1965)
74. Mee J.E., Corbett J.D. Inorg. Chem., 4, 88 (1965).
75. Meyer M. Ber., 20, 681 (1887).
76. Miller J.E., Miller S.E., Himes R.S., J. Amer. Chem. Soc., 81, 4449 (1959).
77. Stubblefield C.T., Eyring L. Ibid., 77, 3004 (1955).
78. Поляченок О.Г., Новиков Г.И."Ж. неорг. химии", 8, 2819 (1963).
79. Поляченок О.Г., Новиков Г.И. Там же, 8, 2631 (1963).
80. Новиков Г.И., Поляченок О.Г. Там же, с. 1053.
81. Bourion F. Compt. Rend., 148, 170 (1909); Ann. Chim. Phys., 20, 547 (1910).
82. Urbain G., Bourion F. Compt. Rend., 153, 1155 (1911).
83. Matignon C., Bourion F. Compt. Rend., 138, 131 (1904); Ann. Chim. Phys., 15, 127 (1905).
84. Klemm W., Schuth W. Z. Anorg. Chem., 184, 352 (1929).
85. Klemm W., Rockstroh J. Ibid., 176, 181 (1928).
86. Matignon C. Ann. Chim. Phys., 8, 364 (1906).
87. Templeton D.H., Carter G.F. J. Phys. Chem., 58, 940 (1954).
88. Chanvenet E. Compt. Rend., 152, 87 (1911).
89. Jantsch G., Alber H., Grubitsch H. Monatsh., 53 - 54, 304 (1929).
90. Schmidt M., Andrieth L.F. Trans. Illinois State Acad. Sci., 28 (2), 133 (1935), согласно Chem. Abs., 30, 3349.
91. Young R.C., Hastings J.L. J. Amer. Chem. Soc., 59, 765 (1937).
92. Reed J.B. et al. Ibid., 57, 1159 (1935); Inorg. Syn., 1, 28 (1939).
93. Kiesse N.H. J. Res. Nat. Bur. Std., 67A, 343 (1963).
94. Hecht H., Jander G., Schlappman H. Z. Anorg. Chem., 254, 255 (1947).
95. Machlan G.R. Thesis, Iova State University (1952).
96. Hartley F.R., Wylie A.W. Nature, 161, 241 (1948).
97. Gut R., Gruen D.M. J. Inorg. Nucl. Chem., 21, 259 (1961).
98. Campbell T.T. et al. Burean of Mines Report BM - RI - 5880 (1960).
99. Kleinekse J.H., Kremens H.C. Ibid., 50, 959 (1928).
100. Prandt W., Kogl H. Z. Anorg. Chem., 172, 265 (1928).
101. Block F.E., Campbell T.T. The rare earth (F.H. Spedding, A.H. Daane, Eds), Wiley, New York, 1961, p. 60.
102. Jantsch G. et al. Z. Anorg. Chem., 172, 265 (1928).
103. Jantsch G., Skalla N., Grubitsch H. Ibid.,216, 75 (1933).
104. Harrison E.R. J. Appl. Chem., 2, 601 (1952).
105. Heap W., Newbury E. Brit. Pat. 130365 (1918); U.S. Pat 13312, 57 (1918).
106. Freeman J.H., Smith M.L. J. Inorg. Nucl. Chem., 7, 224 (1958).
107. Hermann R. J. Prakt. Chem., 32, 385 (1861).
108. Taylor M.D., Carter C.P. J. Inorg. Nucl. Chem., 24, 387 (1960).
109. Новиков Г.И., Толмачев В.Д. "Ж. неорг. химии", 38, 1142 (1965).
110. Brauman P., Takrovian S. Compt. Rend., 194, 1579 (1932).
111. Muthmann W., Stutzel L. Ber., 32, 3413 (1899).
112. Moissan H. Compt. Rend., 122, 357 (1895).
113. "Химия и технология редких и рассеянных элементов", ч.2; под ред. К.А. Большакова. М., ВШ, 1976, 360с.
PAGE
PAGE 16
Похожие работы
... (tпл. GdCl3 = 610˚C), остывший трихлорид хранили в герметически закрытых ампулах. Все операции с солью проводились в сухом боксе. Глава Ш. Исследование совместного электровосстановления гадолиния и алюминия в галогенидных расплавах. Из анализа литературных данных следует, что процесс электровосстановления алюминия из хлоридных и фторидных расплавов изучался в основном на платиновом ...
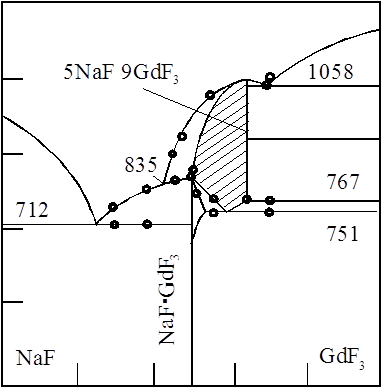
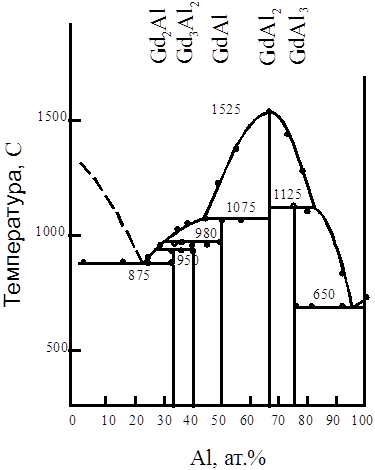
0 комментариев