Навигация
Исследование совместного электровосстановление гадолиния и криолита в галогенидных расплавах
Министерство общего и профессионального образования
Российской Федерации
Кабардино-Балкарский Ордена Дружбы народов Государственный
Университет им. Х.М.Бербекова
Химический факультет
Кафедра неорганической и физической химии
КВАЛИФИКАЦИОННАЯ РАБОТА
на тему:
“Исследование совместного электровосстановления гадолиния и криолита в галогенидных расплавах”
Дипломник: студент 4 курса ХФ ______________Жекамухов А.Б.
Научный руководитель: доктор
химических наук, профессор
кафедры физической химии
__________________Кушхов Х.Б.
рецензент:
Нальчик 1999Содержание стр. Введение……………………………………………………………………4 Глава I. Строение и электрохимическое поведение расплавленных галогенидных систем содержащих гадолиний и алюминий.……………6
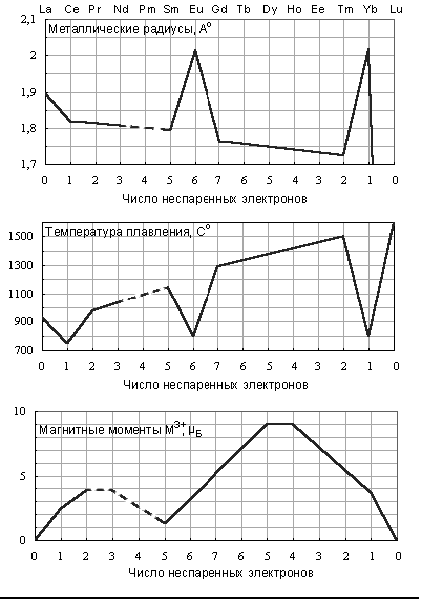
1.1.1.Строение индивидуального расплава трихлорида гадолиния.………..6
1.1.2. Строение растворов расплава трихлорида гадолиния в хлоридах
щелочных металлов..………………………………………………..……..….8
1.1.3. Строение растворов расплава трихлорида гадолиния в хлоридно-фторидных расплавах..………………………………………………..………10
1.1.4. Строение гадолинийсодержащих фторидных расплавов.…...………11
1.2. Электрохимическое поведение гадолинийсодержащих галогенидных расплавов……………..………………………………………………..………16
1.2.1. Электрохимическое поведение гадолинийсодержащих хлоридных расплавов.…………..………………………………………………..……..16
1.2.2. Электрохимическое поведение гадолинийсодержащих фторидных расплавов.…………..………………………………………………..……..19
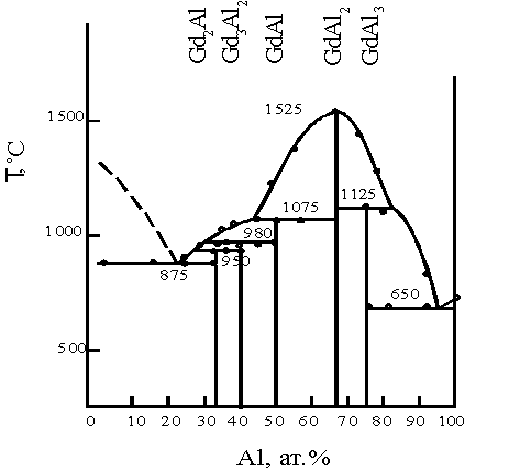
1.3.1. Строение и химические свойства алюминийсодержащих галогенидных расплавов.………..………………………………………………..…....21
1.3.2. Электрохимическое поведение алюминийсодержащих галогенидных расплавов.………..………………………………………………..…....24
Глава II.
Методы исследования и методика проведения экспериментов.
2.1. Выбор электрохимических методов исследования электродных процессов в расплавленных средах и применяемая аппаратура.……..…....28
2.2. Конструкция высокотемпературной кварцевой электрохимической ячейки и электродов.…………………………………………………..37
2.3. Методика получения безводного хлорида гадолиния.……………...39
Глава Ш.
Исследование совместного электровосстановления гадолиния и алюминия в галогенидных расплавах.
3.1. Исследование электровосстановления фторалюминат-иона на фоне
хлоридного расплава KCl-NaCl, влияние фторид-иона..…………...40
3.2. Исследование совместного электровосстановления фторалюминат-
иона и хлоридных комплексов гадолиния на фоне хлоридных и хлоридно-фторидных расплавов………………………………….……...46
Выводы……………………………….……………………….……………...52
Литература…………………….…….……………………….……………....53
ВВЕДЕНИЕ.
Судя по последним публикациям, нынче довольно трудно отметить те стороны жизни, где бы не находили применение редкоземельные элементы. Эти металлы и их сплавы обычно извлекаются из хлоридных и фторидных систем. Соответственно существует достаточно большое количество работ по хлоридным расплавам, однако по хлоридно-фторидным и фторидным системам, особенно по многокомпонентным фторидным расплавленным солям опубликовано довольно ограниченное число работ. [1]
На основе РЗМ получают многие уникальные материалы, которые находят широкое применение в различных областях науки и техники. Например, РЗМ используют как добавки к стали и в сплавах с другими металлами, в производстве материалов, адсорбирующих водород (например, LaNi5), как добавки к ядерным материалам, в качестве пирофорных материалов, в специальной керамике, оптических стеклах (стекла для TV-экранов), в производстве катализаторов для утилизации выхлопных газов, а также в получении магнитных материалов (например (Nd1-xDyx)15Fe77B8 или (Nd1-xDyx)15Fe76B8) и так далее.
Перечисленное выше – лишь небольшая часть из списка областей применения РЗМ. Развитие высоких технологий все более и более вовлекает использование РЗМ, степень чистоты которых должна быть очень высока. В этом отношении не будет преувеличением отнести РЗЭ к материалам XXI века.
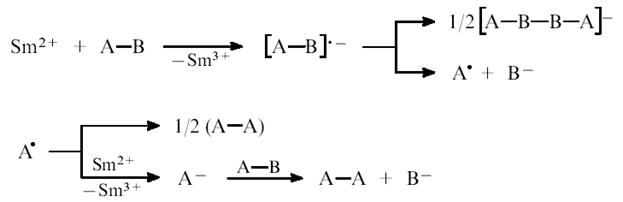
Перспективным способом получения чистых РЗМ и их сплавов с другими металлами является электролиз расплавленных солей РЗЭ, а также их смесей. Для эффективного использования электролитического метода получения РЗМ необходимо располагать надежной информацией об электрохимическом поведении комплексов, образуемых ионами РЗЭ в расплавах, а также химических реакциях, сопровождающих процессы электроосаждения. Поэтому является необходимым выяснение механизма электровосстановления комплексных ионов РЗЭ, в частности совместного электровосстановления гадолиния и криолита в галогенидных расплавах.
Глава I. Строение и электрохимическое поведение расплавленных галогенидных систем, содержащих гадолиний и алюминий.
Похожие работы
... H2O + Cl2 NaOH + CeO2 = Na2CeO3 + H2O а соединения со степенью окисления II (Eu, Sm, Yb) – восстановительные, причем окисляются даже водой: 2SmCl2 + 2H2O = 2SmOHCl2 + H2 Лантаноиды очень реакционноспособны и легко взаимодействуют со многими элементами периодической системы: в кислороде сгорают при 200–400 °С с образованием Э2O3, а в атмосфере азота при 750–1000 °С образуют ...
0 комментариев