Навигация
Перенапряжение ионизации кислорода
3.2 Перенапряжение ионизации кислорода.
Перенапряжение ионизации кислорода чаще всего появляется в сильно перемешанных растворах, при интенсивной аэрации раствора (баротаж воздуха и др.), при наличии на металле тонкой пленки электролита (влаги) как и в случае с любой другой катодной реакцией восстановление перенапряжение ионизации кислорода зависит от катодной плотности тока, материала катода, температуры и некоторых других факторов.
Если плотность тока достаточно высока i> А/м то перенапряжение ионизации кислорода является линейной функцией lgi т.е. имеет место зависимость тапа уравнения Тафеля
V = - (Vk)э=х = a+b lg ik
где а - постоянная зависящая от молярности катода его состояния, Т и пр., численно а=h при i=1; b постоянная зависящая от механизма возникновения перенапряжения. При заторможенности только реакции взаимодействия кислорода с электроном
b=(RT/BnF)n 2,303 = 0,118/ n
Зависимость перенапряжения ионизации кислорода на металлах в растворе: 0,5NaCl + 0,005MNaCO + 0,005MNaHCO (pH=9,2) в атмосфере кислорода при 20 С, раствор перемешивался а) в координатах б) в координатах .
Катодная реакция ионизации кислорода состоит из цепи последовательных элементарных реакций, т.е. протекает стадийно:
а) образование молекулярного иона кислорода
O2+e = O2-
б) образование пергидроксила
O2- + H+ = HO2
в) образование пергидроксила иона
HO2 + e = HO2-
г) образование перекиси водорода.
HO2- + H+ = H2O2
д) восстановление перекиси водорода до гидроксил иона и гидроксил-радикала
H2O2 +e = OH- + OH
е) Восстановление гидроксил-радикала до гидроксил иона
OH + e = OH-
Для ряде металлов (Fe,Cu,Au,Pt) при 25 С const b=0.10..0.13.
Это свидетельствует о том, что причиной перенапряжения ионизации кислорода является замедленность элементарной реакции ассимиляции одного электрона (n=1). Для кислых растворов такой реакцией является, по видимому, образование молекулярного иона кислорода
(а), а для щелочных сред - образование пергидроксил-иона (в).
Глава 2
Электрохимические методы защиты металлов от коррозии.
1.Методы защиты металлов от коррозии.
В зависимости от характера коррозии и условий ее протекания применяются различные методы защиты. Выбор того или иного способа определяется его эффективностью в данном конкретном случае, а также экономической целесообразностью. Любой метод защиты изменяет ход коррозионного процесса, либо уменьшая скорость, либо прекращая его полностью. Коррозионные диаграммы, наиболее полно характеризующие коррозионный процесс, должны отражать и те изменения в ходе протекания, какие наблюдаются в условиях защиты. Коррозионные диаграммы можно использовать, поэтому при разработке возможных путей предохранения металлов от коррозии. Они служат основой для выяснения принципиальных особенностей того или иного метода. В связи с этим при рассмотрении существующих методов защиты поляризационные диаграммы будут использованы в их несколько упрощенном виде (4). На таких диаграммах постулируется линейная зависимость между плотностью и потенциалом каждой частной реакции. Это упрощение оказывается вполне допустимым при качественной оценке особенностей большинства методов
Эффективность защиты выражают через коэффициент торможения γ или степень защиты Z. Коэффициент торможения показывает, во сколько раз уменьшается скорость коррозии в результате применения данного способа защиты
![]()
где ![]() и
и ![]() - скорость коррозии до и после защиты. Степень защиты указывает, насколько полно удалось подавить коррозию благодаря применению этого метода:
- скорость коррозии до и после защиты. Степень защиты указывает, насколько полно удалось подавить коррозию благодаря применению этого метода:
![]()
или
![]()
2 Катодная защита
Из всех методов защиты основанных на изменении электрохимических свойств металла под действием поляризующего тока, наибольшее распространение получила защита металлов при наложении на них катодной поляризации (катодная защита). При смещении потенциала металла в сторону более электроотрицательных значений (по сравнению с величиной стационарного потенциала коррозии) скорость катодной реакции увеличивается, а скорость анодной падает (см. рис. 1). Если при стационарном потенциале ![]() соблюдалосьравенство
соблюдалосьравенство
![]() ,
,
то при более отрицательном значении ![]() это равенство нарушается:
это равенство нарушается:
![]()
причем
![]() .
.
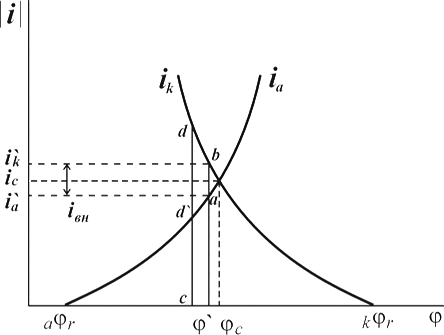
Рис. 1. Поляризационная диаграмма коррозионного процесса.
Уменьшение скорости анодной реакции при катодной поляризации эквивалентно уменьшению скорости коррозии. Коэффициент торможения при выбранном потенциале j/ (см.рис.4) будет равен двум
![]() =
=![]() =
=![]() =2,
=2,
а степень защиты достигает 50%
![]() =
=![]()
![]() =
=![]() .
.
Внешний ток ![]() , необходимый для смещения потенциала до значения
, необходимый для смещения потенциала до значения ![]() , представляет собой разницу между катодным и анодным токами
, представляет собой разницу между катодным и анодным токами
![]()
(его величина на рис.4 выражена прямой ав). По мере увеличения внешнего тока потенциал смещается в более отрицательную сторону, и скорость коррозии должна непрерывно падать. Когда потенциал корродирующего металла достигает равновесного потенциала анодного процесса ![]() , скорость коррозии делается равной нулю (
, скорость коррозии делается равной нулю (![]() ), коэффициент торможения – бесконечности, а степень защиты 100%. Плотность тока, обеспечивающая полную катодную защиту, называется защитным током
), коэффициент торможения – бесконечности, а степень защиты 100%. Плотность тока, обеспечивающая полную катодную защиту, называется защитным током ![]() .Его величине на рис.4 соответствует отрезок cd. Величина защитного тока не зависит от особенностей протекания данной анодной реакции, в частности от величины сопровождающей ее поляризации, а целиком определяется катодной поляризационной кривой. Так, например, при переходе от водородной деполяризации к кислородной сила защитного тока уменьшается и становится равной предельному диффузному току (отрезок cd / на рис.4).
.Его величине на рис.4 соответствует отрезок cd. Величина защитного тока не зависит от особенностей протекания данной анодной реакции, в частности от величины сопровождающей ее поляризации, а целиком определяется катодной поляризационной кривой. Так, например, при переходе от водородной деполяризации к кислородной сила защитного тока уменьшается и становится равной предельному диффузному току (отрезок cd / на рис.4).
Защита металла катодной поляризацией применяется для повышения стойкости металлических сооружений в условиях подземной (почвенной) и морской коррозии, а также при контакте металлов с агрессивными химическими средами. Она является экономически оправданной в тех случаях, когда коррозионная среда обладает достаточной электропроводностью, и потери напряжения (связанные с протеканием защитного тока), а следовательно, и расход электроэнергии сравнительно невелик. Катодная поляризация защищаемого металла достигается либо наложением тока от внешнего источника (катодная защита), либо созданием макрогальванической пары с менее благородным металлом (обычно применяются алюминий, магний, цинк и их сплавы). Он играет здесь роль анода и растворяется со скоростью, достаточной для создания в системе электрического тока необходимой силы (протекторная защита). Растворимый анод при протекторной защите часто называют “жертвенным анодом”.
Катодная защита обычно связана с защитой черных металлов, так как из них изготавливается подавляющая часть объектов работающих под землей и при погружении в воду, например трубопроводы, свайные основания, пирсы, эстакады, суда и др. В качестве материала для расходуемых анодов-протекторов во всем мире широко применяется магний. Обычно он используется в виде сплавов с содержанием 6% алюминия, 3% цинка и 0,2% марганца; эти добавки предотвращают образование пленок, которые снижают скорость растворения металла. Выход защитного тока всегда меньше 100%, так как магний корродирует и на нем выделяется водород. Применяется также алюминий, легированный 5% цинка, но разность потенциалов с железом для сплава значительно меньше, чем для магниевого сплава. Она близка к разности потенциалов для металлического цинка, который также применяется для защиты при условии, что путем соответствующего легирования на анодах предотвращается пленкообразование, связанное с обычным для цинка загрязнением примесями железа Выбор материала для анодов - сложная задача. В почвах или других средах низкой проводимости необходима большая разность потенциалов, поскольку падение iR между электродами весьма велико, в то время как в средах высокой проводимости возможна более экономичная для использования малая разность потенциалов. Важными переменными являются расположение электродов, рассеивающая способность среды, т. е. ее способность обеспечить одинаковую плотность тока на всех участках защищаемой поверхности, а также поляризационные характеристики электродов. Если электроды погружены в почву, которая по каким – либо причинам неприемлема, например агрессивна по отношению к анодам, то обычно практикуется окружать последние ложем из нейтрального пористого проводящего материала, называемого засыпкой.
Применение для катодной защиты метода приложения тока облегчает регулирование системы и часто дешевле, чем использование анодов – протекторов, которые, конечно, нуждаются в регулярных заменах.
На практике катодная защита редко применяется без дополнительных мероприятий. Требуемый для полной защиты ток обычно бывает чрезмерно велик, и помимо дорогостоящих электрических установок для его обеспечения следует иметь в виду, что такой ток часто будет вызывать вредный побочный эффект, например чрезмерное защелачивание. Поэтому катодная защита применяется в сочетании с некоторыми видами покрытий. Требуемый при этом ток мал и служит только для защиты обнаженных участков поверхности металла.
3 Явление пассивности.Давно известно, что скорость коррозии многих металлов часто значительно меньше в растворах сильных окислителей, чем в растворах окислителей более слабых. Сюда относятся такие металлы, как железо, хром, никель, титан, цирконий, алюминий и многие другие. Резкое уменьшение скорости коррозии (на несколько порядков) в сильных окислителях, казалось бы противоречащее термодинамическим свойствам металла и окислителя, называется пассивацией, а состояние металла – пассивным.
Некоторые металлы находятся в пассивном (или близком к пассивному) состоянии даже в таких слабых окислителях, как вода. Это дает возможность практически использовать в качестве конструкционных материалов магний, титан, алюминий и многие другие.
М.В. Ломоносов был, по-видимому, первым исследователем, обратившим внимание на пассивность железа в концентрированной азотной кислоте. Железу посвящены наблюдения М. Фарадея и Х. Шенбейна. М. Фарадей сделал удивительную по научной дальновидности попытку объяснить пассивность железа образованием на поверхности слоя (пленки) окисла или же существованием поверхностных атомов металла в таком состоянии, которое равноценно окислению.
Очень большое практическое значение пассивности, часто определяющее возможность получения сплавов, химически стойких в агрессивных средах, вызвало огромное количество исследований, посвященных изучению пассивного состояния. Если отбросить некоторые несущественные различия, высказываемые на основании сопоставления экспериментальных данных, сказав, что пассивное состояние обусловлено образованием очень тонкой пленки окисла, представляющего собой отдельную фазу, или слоя хемисорбированного кислорода, а может быть и других частиц. Ограничимся представлением о некотором кислородном «барьере», образующемся на поверхности металла в подходящем окислителе и сильно тормозящем анодный процесс.
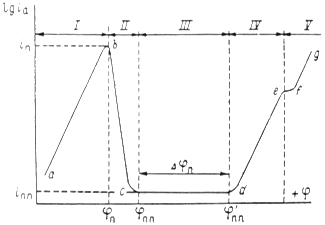
Рис. 2. Полная анодная поляризационная кривая: I – активное растворение; II – переход в пассивное состояние; III – пассивность; IV – перепассивация; V – выделение кислорода.
На рис.5 приведена анодная кривая, которую мы подробно рассмотрим. Активное растворение продолжается до потенциала, отвечающего точке b. При этом ток равен критическому току пассивации ![]() , а потенциал обозначен символом
, а потенциал обозначен символом ![]() .На участке bс (в интервале потенциалов
.На участке bс (в интервале потенциалов ![]() -
- ![]() ) происходит пассивация.
) происходит пассивация. ![]() и
и ![]() можно назватьпотенциалом и током полной (наилучшей) запассивированности. Это название не вполне точно, так как на реальных поляризационных кривых линия cd редко бывает строго горизонтальной; но сравнительно небольшими вариациями тока
можно назватьпотенциалом и током полной (наилучшей) запассивированности. Это название не вполне точно, так как на реальных поляризационных кривых линия cd редко бывает строго горизонтальной; но сравнительно небольшими вариациями тока ![]() в интервале cd часто можно пренебречь. Потенциал
в интервале cd часто можно пренебречь. Потенциал ![]() и ток
и ток ![]() являются важными характеристиками электрода, показывающими, насколько легко металл переходит в пассивное состояние. Чем отрицательнее
являются важными характеристиками электрода, показывающими, насколько легко металл переходит в пассивное состояние. Чем отрицательнее ![]() и чем меньше
и чем меньше ![]() , тем легче наступает пассивность. Интервал потенциалов
, тем легче наступает пассивность. Интервал потенциалов ![]() отвечает условиям, в которых сохраняется пассивное состояние. Чем больше
отвечает условиям, в которых сохраняется пассивное состояние. Чем больше ![]() , тем в более широких пределах изменение потенциала будет сохранять пассивное состояние. Выше потенциала
, тем в более широких пределах изменение потенциала будет сохранять пассивное состояние. Выше потенциала ![]() скорость окисления снова увеличивается ( участок cе ) и металл оказывается в области перепассивации или в транспассивном состоянии. Иными словами, отклонение значения потенциала от равновесного значения называется перепассивацией. При еще более высоком потенциале становится возможным процесс окисления ионов гидроксила и выделение кислорода: 4ОН-→ 2Н2О + О2 + 4е. Это соответствует участку fg. Если этот последний процесс определяет кинетику анодной реакции, то угловой коэффициент прямой fg соответствует окислению ионов ОН-.
скорость окисления снова увеличивается ( участок cе ) и металл оказывается в области перепассивации или в транспассивном состоянии. Иными словами, отклонение значения потенциала от равновесного значения называется перепассивацией. При еще более высоком потенциале становится возможным процесс окисления ионов гидроксила и выделение кислорода: 4ОН-→ 2Н2О + О2 + 4е. Это соответствует участку fg. Если этот последний процесс определяет кинетику анодной реакции, то угловой коэффициент прямой fg соответствует окислению ионов ОН-.
При изменение потенциала в обратном направлении кривая, вообще говоря, имеет такой же ход. В таком случае ![]() будет потенциалом начала потери пассивности (депассивации). Его иногда называют фладе-потенциало (
будет потенциалом начала потери пассивности (депассивации). Его иногда называют фладе-потенциало (![]() ) по имени исследователя, изучавшего депассивацию железа.
) по имени исследователя, изучавшего депассивацию железа.
В настоящее время вопрос сводится к изучению природы защитных образований на металле, в которых обычно участвует кислород.
При более высоком потенциале становится возможным процесс выделения кислорода:
2Н2О – 4е = 2Оадс + 4Н+
О2 = 2Оадс
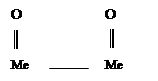 |
Между адсорбированным кислородом и металлом возникают химические связи (хемисорбция), иначе говоря на поверхности металла возникает хемисорбированная пленка:
Из-за неоднородности поверхности пленка может где-то образовываться, а где-то нет. Там, где есть пленка, не происходит окисление металла.
4 Анодная защита. Использование пассивности в практике защиты от коррозии. Многие металлы находятся в пассивном состоянии в некоторых агрессивных средах. Хром, никель, титан, цирконий легко переходят в пассивное состояние и устойчиво его сохраняют. Часто легирование металла, менее склонного к пассивации, металлом, пассивирующем легче, приводит к образованию достаточно хорошо пассивирующихся сплавов. Примером могут служить разновидности сплавов FeCr, представляющие собой различные нержавеющие и кислотоупорные стали, стойкие, например, в пресной воде, атмосфере, азотной кислоте и т.д. Для практического использования пассивности нужно такое сочетание свойств металла и среды, при котором последняя обеспечивает значение стационарного потенциала, лежащего в области ![]() . Подобное использование пассивности в технике защиты от коррозии известно давно и имеет огромное практическое значение.
. Подобное использование пассивности в технике защиты от коррозии известно давно и имеет огромное практическое значение.
Но в последнее время возникло новое направление защиты металлов в таких окислителях, которые сами по себе не способны вызывать пассивность. Известно, что смещение потенциала активного металла в отрицательную сторону должно уменьшить скорость коррозии. Если потенциал становится отрицательнее равновесного в данной среде, то скорость коррозии должна стать равной нулю (катодная защита, применение протекторов). Очевидно, что подобным же образом, но за счет анодной поляризации от внешнего источника электрической энергии можно перевести способный к этому металл в пассивное состояние и тем уменьшить скорость коррозии на несколько порядков. Расход электрической энергии не должен быть велик, так как сила тока в области ![]() вообще весьма мала.
вообще весьма мала.
Существуют требования, которым должна удовлетворять система, чтобы к ней можно было применить анодную защиту. Прежде всего, нужно надежно знать анодную поляризационную кривую для выбранного металла в данной агрессивной среде. Чем выше ![]() , тем большая сила тока потребуется для перевода металла в пассивное состояние; чем меньше
, тем большая сила тока потребуется для перевода металла в пассивное состояние; чем меньше ![]() , тем меньший расход энергии потребуется для поддержания пассивности; чем шире диапазон
, тем меньший расход энергии потребуется для поддержания пассивности; чем шире диапазон ![]() , тем большие колебания потенциала можно допустить, т.е. тем легче поддерживать металл в пассивном состоянии. Нужна уверенность в том, что в области
, тем большие колебания потенциала можно допустить, т.е. тем легче поддерживать металл в пассивном состоянии. Нужна уверенность в том, что в области ![]() металл корродирует равномерно. В противном случае, даже при малой величине
металл корродирует равномерно. В противном случае, даже при малой величине ![]() , возможно образование язв и сквозного разъедания стенки изделия. Форма защищаемой поверхности может быть довольно сложной, что затрудняет поддержание одинакового значения потенциала на всей поверхности; в этом отношении большая величина
, возможно образование язв и сквозного разъедания стенки изделия. Форма защищаемой поверхности может быть довольно сложной, что затрудняет поддержание одинакового значения потенциала на всей поверхности; в этом отношении большая величина ![]() особенно желательна. Конечно, требуется и достаточно хорошая электропроводность среды.
особенно желательна. Конечно, требуется и достаточно хорошая электропроводность среды.
![]() Применение анодной защиты целесообразно в сильно агрессивных средах, например в химической промышленности. При наличие поверхности раздела жидкость-газ необходимо иметь в виду, что анодная защита не может распространяться на поверхность металла в газовой среде, что впрочем типично и для катодной зашиты. Если газовая фаза тоже агрессивна или имеется неспокойная поверхность раздела, что приводит к разбрызгиванию жидкости и оседанию капель ее на металл выше поверхности раздела, если происходит периодическое смачивание стенки изделия в определенной зоне, то приходится ставить вопрос об иных способах защиты поверхности выше постоянного уровня жидкости.
Применение анодной защиты целесообразно в сильно агрессивных средах, например в химической промышленности. При наличие поверхности раздела жидкость-газ необходимо иметь в виду, что анодная защита не может распространяться на поверхность металла в газовой среде, что впрочем типично и для катодной зашиты. Если газовая фаза тоже агрессивна или имеется неспокойная поверхность раздела, что приводит к разбрызгиванию жидкости и оседанию капель ее на металл выше поверхности раздела, если происходит периодическое смачивание стенки изделия в определенной зоне, то приходится ставить вопрос об иных способах защиты поверхности выше постоянного уровня жидкости.
Анодная защита может осуществляться несколькими способами.
1. Простое наложение постоянной э.д.с. от постороннего источника электрической энергии. Положительный полюс подключается к защищаемому изделию, а около его поверхности помещают катоды сравнительно малого размера. Они размещаются в таком количестве и на таком расстоянии от защищаемой поверхности, чтобы обеспечить по возможности равномерную анодную поляризацию изделия. Этот способ применяется в том случае, если ![]() достаточно велик и нет опасности, при некоторой неизбежной неравномерности распределения потенциала анода, активации или перепассивации, т.е. выхода за пределы
достаточно велик и нет опасности, при некоторой неизбежной неравномерности распределения потенциала анода, активации или перепассивации, т.е. выхода за пределы ![]() .
.
Таким способом можно защищать изделия из титана или циркония в серной кислоте. Нужно только помнить, что для пассивации сначала потребуется пропускание тока большей силы, что связано с переводом потенциала за ![]() . Для начального периода целесообразно иметь дополнительный источник энергии. Следует учитывать также большую поляризацию катодов, плотность тока на которых велика вследствие их малых размеров. Однако, если область пассивного состояния велика, то изменение потенциала катода даже на несколько десятых вольта не представляет опасности.
. Для начального периода целесообразно иметь дополнительный источник энергии. Следует учитывать также большую поляризацию катодов, плотность тока на которых велика вследствие их малых размеров. Однако, если область пассивного состояния велика, то изменение потенциала катода даже на несколько десятых вольта не представляет опасности.
Периодическое включение и выключение тока защиты, когда изделие уже занассивировано. При включение анодного тока потенциал изделия смещается в отрицательную сторону, причем может произойти депассивация. Но поскольку иногда это происходит довольно медленно, простая автоматика может обеспечить включение и выключение защитного тока в нужное время. Когда потенциал дойдет до величины ![]() , т.е. до начала перепассивации, ток выключается; когда потенциал сдвинется в отрицательную сторону до
, т.е. до начала перепассивации, ток выключается; когда потенциал сдвинется в отрицательную сторону до ![]() (начало активации), ток снова включается. Смещение потенциала в катодную сторону происходит тем медленнее, чем меньше
(начало активации), ток снова включается. Смещение потенциала в катодную сторону происходит тем медленнее, чем меньше ![]() . Чем ближе был потенциал к величине
. Чем ближе был потенциал к величине ![]() , тем медленнее он смещается в отрицательную сторону (в направлении
, тем медленнее он смещается в отрицательную сторону (в направлении ![]() ) при выключении тока. Например, для хрома в 0,1н. растворе H2SO4 при 750 С, если выключение тока произошло при
) при выключении тока. Например, для хрома в 0,1н. растворе H2SO4 при 750 С, если выключение тока произошло при ![]() =0,35 в, активация наступит через 2 ч; выключение тока при
=0,35 в, активация наступит через 2 ч; выключение тока при ![]() =0,6 в вызывает активацию через 5 ч; выключение же при
=0,6 в вызывает активацию через 5 ч; выключение же при ![]() =1,05в увеличивает срок начала активации более чем до 127 ч. Столь большое время, необходимое для депассивации, позволяет делать значительные перерывы в подаче тока. Тогда одной и той же установкой можно обслужить несколько объектов.
=1,05в увеличивает срок начала активации более чем до 127 ч. Столь большое время, необходимое для депассивации, позволяет делать значительные перерывы в подаче тока. Тогда одной и той же установкой можно обслужить несколько объектов.
Зависимость времени запассивации от потенциала включения легко объяснима при помощи концепции фазового окисла (образуется более толстый слой окисла, растворение которого требует больше времени). Труднее объяснить это явление десорбцией пассивирующего кислорода. Конечно, с ростом положительного значения потенциала прочность связи в адсорбционном слое должна увеличиваться. Но при включении тока разряд двойного слоя происходит сравнительно быстро, хотя адсорбционный слой, возможно, сохраняется долго.
3. Если область пассивного состояния (![]() ) мала, то необходимо применение потенциостата, поддерживающего заданную величину потенциала (относительно некоторого электрода сравнения) в узких границах. Потенциостат должен быть способен давать большую силу тока.
) мала, то необходимо применение потенциостата, поддерживающего заданную величину потенциала (относительно некоторого электрода сравнения) в узких границах. Потенциостат должен быть способен давать большую силу тока.
В настоящее время уже имеется ряд установок для анодной защиты, осуществленных в промышленном масштабе. Защищаются изделия и из обычной углеродистой стали. При анодной защите не только увеличивается срок службы аппаратуры, но также уменьшается загрязнение агрессивной среды продуктами коррозии. Например, в олеуме углеродистая сталь корродирует очень медленно и в этом смысле не нуждается в защите. Но в сосудах для хранения этого продукта происходит загрязнение его железом. Так, без анодной защиты в одной из промышленных установок содержание железа в олеуме составляло ≈ 0,12 %. После наложения защиты концентрация железа снизилась до ≈ 0,004 %, что соответствует его содержанию в исходном продукте. Загрязнение продуктов химической промышленности примесями соединений металлов, являющееся следствием коррозии аппаратуры, во многих случаях весьма нежелательно и даже недопустимо.
Однако, использование анодной защиты связано со значительными трудностями. В то время как катодная защита может употребляться для защиты многих металлов, погруженных в любую электропроводящую среду, например твердую или жидкую, анодная защита применяется только для защиты целых секций химических установок, которые изготовлены из металла, способного пассивироваться в рабочей среде. Именно это и ограничивает ее применение. Кроме того, анодная защита потенциально опасна, поскольку при перерывах подачи тока без немедленного восстановления защиты на рассматриваемом участке начнется очень быстрое растворение, так как разрыв в пленке образует путь с низким сопротивлением в условиях анодной поляризации металла.
Использование анодной защиты требует тщательного проектирования химической установки. Последняя должна иметь такую систему контроля, чтобы любая потеря защиты немедленно привлекала внимание оператора. Для этого может быть достаточным только локальное повышение анодного тока, однако в наихудшем случае может потребоваться немедленное опорожнение всей установки.
Анодная защита не обеспечивает стойкости в присутствии агрессивных ионов. Так, хлоридные ионы разрушают пассивную пленку, а потому их концентрация должна поддерживаться низкой, за исключением защиты титана, который может пассивироваться в хлористоводородной кислоте. В условиях анодной защиты имеет место хорошая рассеивающая способность электролитов и поэтому для поддержания ее установленной защиты требуется сравнительно небольшое количество электродов. Однако при проектировании установок анодной защиты следует учитывать, что в условиях, предшествующих пассивации, рассеивающая способность хуже.
Анодная защита потребляет очень мало энергии и может применяться для защиты обычных конструкционных металлов, способных пассивироваться, например углеродистой и нержавеющей стали, во многих средах. Эта защита легко подвергается контролю и измерениям и не требует дорогостоящей обработки поверхности металла, так как использует самопроизвольный эффект реакции между стенками емкостей и их содержимым. Способ изящен, и его применение, по-видимому, будет расширяться, как только будут преодолены сложности измерения и контроля.
5 Покрытия, как метод защиты металлов от коррозии.Защита металлов, основанная на изменение их свойств, осуществляется или специальной обработкой их поверхности, или легированием. Обработка поверхности металла с целью уменьшения коррозии проводится одним из следующих способов: покрытием металла поверхностными пассивирующими пленками из его трудно растворимых соединений (окислы, фосфаты, сульфаты, вольфраматы или их комбинации), созданием защитных слоев из смазок, битумов, красок, эмалей и т.п. и нанесением покрытий из других металлов, более стойких в данных конкретных условиях, чем защищаемый металл (лужение, цинкование, меднение, никелирование, хромирование, свинцование, родирование и т.д.).
Защитное действие большинства поверхностных пленок можно отнести за счет вызванной ими механической изоляции металла от окружающей среды. По теории локальных элементов, их эффект следует рассматривать как результат увеличения электрического сопротивления (рис. 8).
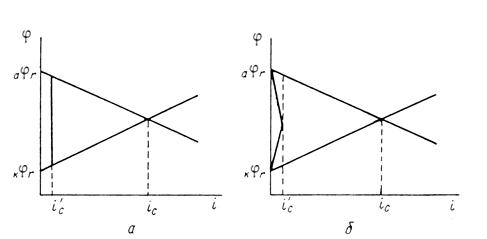
Рис. 3. Коррозионная диаграмма, показывающая, что уменьшение скорости коррозии при нанесении поверхностных защитных слоёв может быть объяснено как увеличением омического сопротивления (а), так и повышением частных коррозионных реакций (б).
Повышение устойчивости железных и стальных изделий при покрытии их поверхности осадками других металлов обусловлено и механической изоляцией поверхности, и изменением ее электрохимических свойств. При этом может наблюдаться или смещение обратимого потенциала анодной реакции в сторону более положительных значений (покрытия медью, никелем, родием), или увеличение поляризации катодной реакции – повышение водородного перенапряжения (цинк, олово, свинец). Как следует из диаграмм (рис.8), все эти изменения уменьшают скорость коррозии.
Обработку поверхности металлов применяют для предохранения машин, оборудования, аппаратов и предметов домашнего обихода при временной защите в условиях транспортировки, хранения и консервации (смазка, пассивирующие пленки) и для более длительной защиты при их эксплуатации (лаки, краски, эмали, металлические покрытия). Общим недостатком этих металлов является то, что при удалении (например, вследствие износа или повреждения) поверхностного слоя скорость коррозии на поврежденном месте резко возрастает, а повторное нанесение защитного покрытия не всегда бывает возможно.
В этом отношении легирование является значительно более эффективным (хотя и более дорогим) методом повышения коррозионной стойкости металлов. Примером повышения коррозийной стойкости металла легированием являются сплавы меди с золотом. Для надежной защиты меди необходимо добавлять к ней значительное количество золота (не менее 52,2 ат.%). Атомы золота механически защищают атомы меди от их взаимодействия с окружающей средой. Несравненно меньше количество легирующих компонентов требуется для повышения устойчивости металла, если эти компоненты способны образовывать с кислородом защитные пассивирующие пленки. Так, введение хрома в количестве нескольких процентов резко увеличивает коррозионную стойкость сталей. Теоретический и практический интерес представляет повышение коррозионной стойкости легированием катодными добавками (Томашов). Для выяснения принципов, на которых основан этот метод, можно, следуя Колотыркину, рассмотреть потенциостатические кривые. В отсутствие внешнего поляризующего тока металл находится при стационарном потенциале ![]() (рис. 9), лежащим в области его активного растворения (до легирования). Скорость коррозии определяется при этом пересечением кривых
(рис. 9), лежащим в области его активного растворения (до легирования). Скорость коррозии определяется при этом пересечением кривых ![]() и соответствует току
и соответствует току ![]() . При введении в исходный металл небольшого количества палладия (или другого металла с низким перенапряжением водорода) поляризационная кривая выделения водорода будет отвечать прямой
. При введении в исходный металл небольшого количества палладия (или другого металла с низким перенапряжением водорода) поляризационная кривая выделения водорода будет отвечать прямой ![]() , которая пересечет анодную кривую уже в области пассивного состояния. В результате этого стационарный потенциал сместится в положительную сторону до некоторого значения
, которая пересечет анодную кривую уже в области пассивного состояния. В результате этого стационарный потенциал сместится в положительную сторону до некоторого значения ![]() , а скорость коррозии снизится до величины
, а скорость коррозии снизится до величины ![]() , отвечающей скорости растворения металла в пассивном состоянии. Таким образом, снижение скорости коррозии достигается за счет уменьшения торможений катодного процесса. Такой механизм защиты возможен лишь в том случае, если обратимый потенциал водородного электрода в данных условиях положительнее, чем Фладе – потенциал, и если точка пересечения катодной и анодной поляризационных кривых лежит в области пассивного состояния металла (рис.9).
, отвечающей скорости растворения металла в пассивном состоянии. Таким образом, снижение скорости коррозии достигается за счет уменьшения торможений катодного процесса. Такой механизм защиты возможен лишь в том случае, если обратимый потенциал водородного электрода в данных условиях положительнее, чем Фладе – потенциал, и если точка пересечения катодной и анодной поляризационных кривых лежит в области пассивного состояния металла (рис.9).
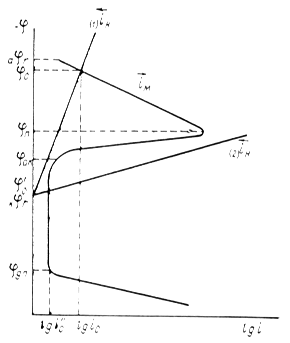
Рис. 4. Поляризационная диаграмма, показывающая возможность защиты пассивирующегося металла от коррозии при увеличении скорости катодного процесса.
6 Ингибиторы.Скорость коррозии можно снизить также изменением свойств коррозионной среды. Это достигается или соответствующей обработкой среды, в результате которой уменьшается ее агрессивность, или введением в коррозионную среду небольших добавок специальных веществ, так называемых замедлителей или ингибиторов коррозии.
Обработка среды включает в себя все способы, уменьшающие концентрацию ее компонентов, особенно опасных в коррозионном отношении. Так, например, в нейтральных солевых средах и пресной воде одним из самых агрессивных компонентов является кислород. Его удаляют деаэрацией (кипячение, дистилляция, барботаж инертного газа) или смазывают при помощи соответствующих реагентов (сульфиты, гидразин и т.п.). Уменьшение концентрации кислорода должно почти линейно снижать предельный ток его восстановления, а следовательно, и скорость коррозии металла. Агрессивность среды уменьшается также при ее подщелачивании, снижение общего содержания солей и замене более агрессивных ионов менее агрессивными. При противокоррозионной подготовке воды для уменьшения накипеобразования широко применяется ее очистка ионнообменными смолами.
Ингибиторы коррозии разделяют, в зависимости от условий их применения, на жидкофазные и парофазные или летучие. Жидкофазные ингибиторы делят в свою очередь на ингибиторы коррозии в нейтральных, щелочных и кислых средах. В качестве ингибиторов для нейтральных растворов чаще всего применяются неорганические вещества анионного типа. Их тормозящее действие связано, по-видимому, или с окислением поверхности металла (нитриты, хроматы), или с образованием пленки труднорастворимого соединения между металлом, данным анионом и, возможно, кислородом (фосфаты, гидрофосфаты). Исключение представляют в этом отношении соли бензойной кислоты, ингибирующий эффект которых связан, главным образом, с адсорбционными явлениями. Все ингибиторы для нейтральных сред тормозят преимущественно анодную реакцию, смещая стационарный потенциал в положительную сторону. До настоящего времени еще не удалось найти эффективных ингибиторов коррозии металлов в щелочных растворах. Некоторым тормозящим действием обладают лишь высокомолекулярные соединения.
В качестве ингибиторов кислотной коррозии применяются почти исключительно органические вещества, содержащие азот, серу или кислород в виде амино-, имино-, тиогрупп, а также в виде карбоксильных, карбонильных и некоторых других групп. Согласно наиболее распространенному мнению, действие ингибиторов кислотной коррозии связано с их адсорбцией на границе раздела металл – кислота. В результате адсорбции ингибиторов наблюдается торможение катодного и анодного процессов, снижающие скорость коррозии.
В связи с преобладающим адсорбционным эффектом органических ингибиторов кислотной коррозии особое значение для понимания механизма их действия и для рационального подхода к созданию новых ингибиторов приобретает величина заряда поверхности корродирующего металла, т.е. величина его ![]() - потенциала. Применение приведенной шкалы потенциалов позволяет использовать данные электрокапиллярных измерений на ртути в растворах, содержащих органические соединения, для оченки их эффективности в качестве ингибиторов при кислотной коррозии железа и других металлов. Значение
- потенциала. Применение приведенной шкалы потенциалов позволяет использовать данные электрокапиллярных измерений на ртути в растворах, содержащих органические соединения, для оченки их эффективности в качестве ингибиторов при кислотной коррозии железа и других металлов. Значение ![]() - потенциала корродирующего металла позволяет не только предсказать, какие вещества могут быть ингибиторами, но и рассчитать коэффициенты торможения. Экспериментальные значения коэффициентов торможения кислотной коррозии железа в присутствии различных количеств диэтиламина, сопоставление с расчетной прямой приведены на рис. 10. Расчетная прямая вычерчена по уравнению
- потенциала корродирующего металла позволяет не только предсказать, какие вещества могут быть ингибиторами, но и рассчитать коэффициенты торможения. Экспериментальные значения коэффициентов торможения кислотной коррозии железа в присутствии различных количеств диэтиламина, сопоставление с расчетной прямой приведены на рис. 10. Расчетная прямая вычерчена по уравнению
![]() ,
,
где ![]() - величина, постоянная для любого члена гомологических рядов аминов и пиридинов, а
- величина, постоянная для любого члена гомологических рядов аминов и пиридинов, а ![]() найдены из электрокапиллярных измерений по ртути.
найдены из электрокапиллярных измерений по ртути.
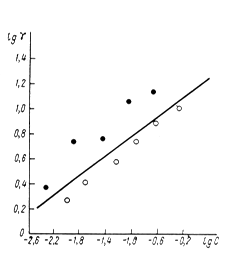
Рис. 5. Сопоставление опытных (-l- и -¡- - данные двух авторов) и расчётных (прямая линия) коэффициентов торможения кислотной коррозии железа при введении разных количеств диэтиланилина.
Адсорбция, однако, является лишь необходимым условием проявления ингибирующего действия органических веществ, но не определяет полностью фактического эффекта ингибиторов. Последний зависит также от многих других факторов – электрохимических особенностей протекания данного коррозионного процесса, характера катодной реакции, величины и природы перенапряжения водорода (при коррозии с водородной деполяризацией), возможных химических превращений ингибитора в ходе коррозии и т.д.
Действие большинства ингибиторов кислотной коррозии усиливается при одновременном введении добавок поверхностно – активных анионов: галогенидов, сульфидов и роданидов.
Парофазные ингибиторы применяются для защиты машин, аппаратов и других металлических изделий во время их эксплуатации в воздушной атмосфере, при транспортировке и хранении. Парофазные ингибиторы вводятся в конвейеры, в упаковочные материалы или помещают в непосредственной близости от работающего агрегата. Благодаря достаточно высокой упругости паров, летучие ингибиторы достигают границы раздела металл – воздух и растворяются в пленке влаги, покрывающей металл. Далее они адсорбируются из раствора на поверхности металла. Тормозящие эффекты в этом случае подобны тем, какие наблюдаются при применение жидкофозных ингибиторов. В качестве парофазных ингибиторов используют обычно амины с небольшим молекулярным весом, в которые введены соответствующие группы, например NО2 или СО2 . В связи с особенностями использования парофазных ингибиторов к ним предъявляются повышенные требования в отношении их токсичности.
Ингибирование – сложный способ защиты, и его успешное применение в различных условиях требует широких познаний.
Глава 3
Обработка резанием.
Обработка резанием является универсальным методом размерной обработки. Метод позволяет обрабатывать поверхности деталей различной формы и размеров с высокой точностью из наиболее используемых конструкционных материалов. Он обладает малой энергоемкостью и высокой производительностью. Вследствие этого обработка резанием является основным, наиболее используемым в промышленности процессом размерной обработки деталей.
Похожие работы
... , в морской воде, в земле, в атмосфере воздуха. Общая схема кислородной деполяризации сводится к восстановлению молекулярного кислорода до иона гидроокисла: O + 4e +2HO 4OH Коррозия металла с кислородной деполяризацией в большинстве практических случаев происходит в электролитах, соприкасающихся с атмосферой, парциальное давление кислорода в которой равно 0,21 атм. Каждый процесс с ...
... Основным критерием, характеризующим состояние поверхности металла, является электродный потенциал. Обычно возможность применения анодной защиты для конкретного металла или сплава определяют методом снятия анодных поляризационных кривых. При этом получают следующие данные: а) потенциал коррозии металла в исследуемом растворе; б) протяженность области устойчивой пассивности; в) плотность тока в ...
... металла с другими металлами и неметаллами. Для количественных измерений коррозии металлов применяют методы: весовой, объёмный, электрический и др. Наиболее распространенный метод измерения скорости коррозии металлов – весовой, Он основан на определении измерения массы образцов после воздействия агрессивной среды. При этом определяют прибыль или убыль массы образца. В первом случае после действия ...
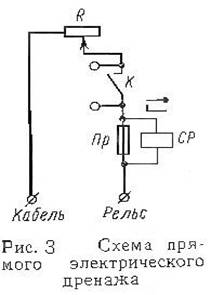
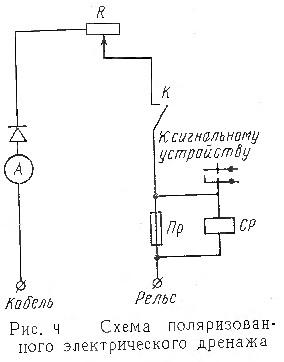
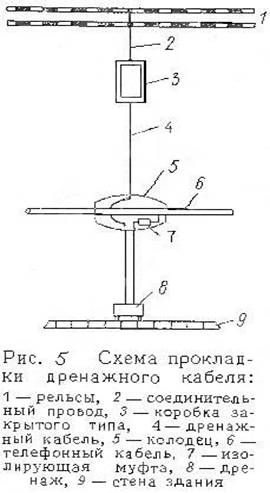
... кабеля. На катодных установках разрешается работать без снятия напряжения, но обязательно в диэлектрических перчатках. Наружный ящик катодной установки должен быть заземлен. Опорный конспект металл коррозия кабель связь Большинство кабелей связи имеет металлическую оболочку, которая подвергается коррозии, т. е. разрушению под влиянием внешней среды. Различают следующие виды коррозии: ...

0 комментариев